
 |
|
|
Литература --> Водородные ионы в производстве изотермы: S-образные части этих изотерм отвечают термодинамически мета-стабильным состояниям. На фиг. 2 изображены для СО экспериментальные /Itm 90 \ 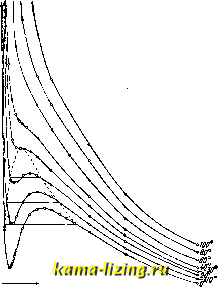 0.02 0.03 Фиг. 1. изотермы: S-образные части кривых заменены прямолинейными частями; справа от этих частей кривые соответствуют газу (ненасыщенному пару), слева - жидкости, а сами прямолинейные отрезки-равновесию пара и жидкости. Ур-ие (15), в полном согласии с опытом, показывает, что с повышением t° размеры прямолинейных отрезков на изотермах делаются все меньше (фиг. 2) и, наконец, при нек-рой t° = t°pum. длина этого отрезка обращается в 0. При t°>t°npum. Г. не может обращаться в жидкость ни при каких давлениях: жидкость перестает существовать. Т. о. уравнение Ван-дер-Ваальса охватывает два состояния-газообразное и жидкое-и служит основанием для учения о непрерьшности перехода между этими двумя состояниями. Критические темп-ры для некоторых Г. имеют следующие значения: -Ь360°С для НгО, Н-31°С для С02,-241°С для Нз и - 254°С для Не. Ожижение Г. Всякий Г. можно обратить в жидкость надлежащим давлением, предварительно охладив его ниже °крит.- Необходимые для ожижения COg давления (в Atm) при разных t° приведены в табл. 2. Табл. 2. - Давления рв, необходимые для ожижения СО, при разных t°.
Понятно, что эти давления являются давлениями насыщенного пара жидкой углекислоты и тем ниже, чем ниже температура. Чтобы предварительно сильно охладить Г. для ожижения, в технич. установках пользуются эффектом Джоуля-То м с о н а, заключающимся в том, что при адиабатическом распшрении (напр., при резком падении давления, когда Г. вытекает из отверстия) внутренняя энергия Г. возрастает на AfJ, а Т изменяется на ДГ, при чем термодинамически В случае идеальных так как, по ур-ию Г. дс/ = о (1), т Для реальных Г. ДГ > О, т. е. происходит охлаждение или нагревание, смотря по тому, будет ли Г- - г; < О (Дг < 0). По уравнению Ван-дер-Ваальса, (с достаточным приближением). Т. о. при достаточно высоких температурах все Г. при адиабатич. расширении нагреваются (ДГ>0, т.к. < Ъ), но с понижением температуры для каждого газа наступает инверсионная точкаГ, определяемая условием 1\= (д) - 6 = 0, ниже крой газы начинают охлаждаться при адиабатическом расширении >6 при T<Tij. Для всех газов, кроме На и Не, Г- лежит выше обычных t° (так, для воздуха Г- соответствует --360°С), и потому Г. могут быть ожижены /гол (16) и ДГ=0 - V = О 90607060504030-  0,0} Фиг. 2. по принципу Линде, без предварительного охлаждения. Для Нг инверсионная точка 1\ -80,5°С, а для Не-даже 15°К; поэтому Нг и Не для ожижения д. б. предварительно охлаждены ниже этих t . Соответственные состояния. Критические температура Гк, давление рк и объем Vn м. б. выражены через константы Ван-дер-Ваальса а, Ъ и R след. образом: Тк=й-;р.=..; г;. = 36. (17) Если за единицы измер. Т, р и v принять соответственно критич. величины, то вместо Т, р я V состояние будет характеризоваться приведенными величинами: Если ввести в, п vl (р в ур-ие Ван-дер-Ваальса (15), то константы а, Ь и Д сократятся, и получится приведенное у р-и е состояния, с численными коэфф-тами (+,)-(3-1) = 80, (19) вовсе не содержащее величин, зависящих от природы вещества. Ур-ие (19) предполагает, однако, правильность ур-ия Ван-дер-Ваальса, и потому уклонения от него часто весьма значительны, особенно в случае ассоциированных веществ. Учение о соответственных состояниях (так называются состояния, отвечающие одинаковым 0, яг и 9?) дает возможность находить большое число универсальных зависимостей, подобных уравнению (19). Применение Г. Сжатые и сжиженные Г. применяются в технике всюду, где нужны значительные количества газа в небольшом объеме; так, СОа применяется для газирования вод, Clg и фосген-в военно-химическом деле, О2-для медицинских целей, сжатый воздух-для пуска двигателей внутреннего сгорания. Особенное значение сжиженные Г. (COg и NHj) имеют в холодильном деле, в холодильных машинах (напр., для получения искусственного льда). Легкие Г. (Hg, светильный газ, в последнее время Не) применяются для наполнения аэростатов. Инертные Г. (Na и благородные Г., особенно Аг) применяются для наполнения полуваттных ламп накаливания. Особняком стоит применение газа, для освещения или в качестве топлива: светильный, силовой, водяной газы и другие (см. Газовое производство). Лит.: Б и р о н Е. В., Учение о газах и жидкостях, М.-П., 1923; Хвольсон О. Д., Курс физики, т. 1, 3, Берлин, 1923; Бачинский А., Введение в кинетич. теорию газов, М., 1908; Тимирязев А. К., Кинетич. теория материи, М.-П., 1923; Van derWaals J. D., t)ber die Konti-nuitat d. gasfSrmigen und fltissigen Zustandes, Lpz., 1899-1900. П. Рвбиндер. ГАЗ, топочный и дымовой. 1) Tone ч н ы м и газами назьшаются продукты сгорания топлива в топке. Различают полное и неполное сгорание топлива. При полном сгорании имеют место след. реакции: с + Ог = COj + 97 200 Cal (газ) 12 32 и с + 2 Hj = СН + 22 500 Cal (газ) 12 4 .16 2Hj, + Os = 2HtO + 2-58 060 Cal (газ) 4 32 36 CH, + 2O2 = 2Н,0 + 19 170 Cal (газ) 16 64 80 5 + о, = SOj + 69 260 Cal (газ) 32 32 64 При неполном сгорании, кроме того, нужно отметить следующие реакции: 2 с -1-0,= 2 со 4- 2-29 160 Cal (газ) 24 32 56 СН, + Оа = 2На0 -1- С -Ь 93 870 Cal (газ) 16 32 36 12 (дьшообразование) Нужно иметь в виду, что SO а-сернистый газ-не есть, собственно, продукт полного сгорания серы; последнее возможно также и по ур-нию: 2S + 30 = 2SOs + 2-91 000 Cal (газ). 64 96 160 Поэтому, когда говорят о полном и неполном сгорании топлива, то имеют в виду только углерод и водород топлива. Здесь не отмечены также реакции, имеющие иногда место при весьма неполн. сгорании, когда в продуктах сгорания, кроме окиси углерода СО, содержатся углеводороды СщНц, водород На, углерод С, сероводород HaS, так как подобное сгорание топлива не должно иметь места на практике. Итак, сгорание можно практически считать полным, если в продуктах сгорания не содержится иных газов, кроме углекислого СОа, сернист, ангидрида SO, кислорода Оа, азота Na и водяного пара НаО. Если сверх этих газов содержится окись углерода СО, то сгорание считается неполным. Присутствие дыма и углеводородов в продуктах сгорания дает основание говорить о неотрегулированной топке. Очень большую роль в подсчетах играет закон Авогадро (см. Атомная теория): в равных объемах газов, как простых, так и сложных, при одинаковых темп-рах и давлениях, содержится одинаковое число молекул, или, что то же: молекулы всех газов при равных давлениях и t° занимают равные объемы. Пользуясь этим законом и зная химический состав топлива, легко вычислить количество Ко кг кислорода, теоретически необходимого для полного сгорания 1 кг топлива данного состава, по следующей ф-ле: :o=o,ol[-c--8(н---)-s], где С,Н, S и О выражают содержание углерода, водорода, серы и кислорода в % веса рабочего топлива. Количество Gq сухого воздуха, теоретически необходимое для окисления 1 кг топлива, определяется по ф-ле; Go = Ко 100 23,1 4,329ЛГо- Приведенное к 0° и 760 мм ртутного столба, это количество может быть выражено в м следующей формулой: д. и. Менделеев предложил весьма простые и удобные для практики соотношения, дающие с достаточной точностью для ориентировочных расчетов результат: У Qpa6. . Qpa6. о ~ 900 ~ - 1 ООО . Qpa6. ., . Qpa6. 1 ООО где Qpa6.-низшая теплопроизводительность 1 кг рабочего топлива. На практике расход воздуха при сгорании топлива бывает больше теоретически необходимого. Отношение количества воздуха, фактически поступившего в топку, к количеству воздуха, теоретически необходимому, называется коэффициентом избытка и обозначается буквой а. Величина этого коэфф-та в топке а зависит от конструкции топки, размеров топочного пространства, расположения поверхности нагрева относительно топки, характера топлива, внимательности работы кочегара и пр. Наименьшую величину коэфф-та -избытка воздуха-ок. 1,1-имеют пылевидные топки, а наибольшую, до 2 и более,-ручные топки для пламенного топлива без вторичного впуска воздуха. От величины коэфф. избытка воздуха в топке зависят состав и количество топочных газов. При точном вычислении состава и количества топочных газов следует также учитывать влагу, внесенную с воздухом за счет его влажности, и водяной пар, расходуемый на дутье. Первая учитывается введением коэфф-та к-рый есть отношение веса водяных паров, заключенных в воздухе, к весу сухого воздуха и м. б. назван коэф ф. влажности воздуха. Второй учитывается величиною Ждз., к-рая равна количеству пара в кг, поступаюшего в топку, отнесенному к 1кг сжигаемого топлива. Пользуясь этими обозначениями, состав и количество топочных газов при полном сгорании можно определить из приведенной таблицы. Z = 20,9 - (3 (COj + SOa) - (СОг + SO, + Oj); (10) SOj = N.-3,785 3S (COj+CO). (12) При расчете новых установок искомым является состав продуктов сгорания COj,-so2, СО, о2 и n2, а данными величинами считаются: состав топлива (C,0,H,S), коэфф. избытка воздуха а и потеря от хим. неполноты сгорания 3. Последними двумя величинами задаются на основании данных испытания аналогичных установок или берут их по оценке. Наибольшие потери от химич. неполноты сгорания получаются в ручных топках для пламенного топлива, когда 3 достигает величины 0,05раб..Отсутствие потери от химическ. неполноты сгорания (§з=0) можно получить в хорошо работающих ручных топках для антрацита, в топках для нефти и для пылевидного топлива, а также в правильно сконструированных механическ. и шахтных топках. При экспериментальном Продукты полного ходе воздуха с Наименование продукта сгорания Вес в т При 0° и 760 мм рт. ст. уд. в. (пг/м ) объем в м Углекислый газ COj Сернистый ангидрид so3........ Кислород Ог . . . . Азот Ns....... ш (а-1) г. Водяные пары Н.О Обычно принято уп1итывать водяные пары НдО отдельно от сухих газов COajSOgjOaiNg и СО, при чем состав последних вычисляют (или определяют экспериментально) в % по объему сухих газов. При полном сгорании топлива должны быть удовлетворены следующие пять уравнений: со, + so, + о, 4- N2 = 100; исследовании существую-\%Фицие/тоГзб т%°а щих ТОПОК прибегают К ана- лизу газов, при чем чаще всего пользуются прибором Орса (см. Анализ газов), дающим состав газов в % по объему сухих газов. Первый отсчет по прибору Орса дает сумму СО, + SOg, т. к. раствор едкого кали КОН, предназначенный для поглощения углекислого газа, одновременно с ним поглощает и сернистый ангидрид SO2. Второй отсчет, после промывки газа во втором сифоне, где находится реактив для поглощения кислорода, дает сумму СО + -j- so2+o2. Разница их дает кислорода о2 в % объема су-остальные величины нахо- ! 3,329 а Ка + N 100 9H+W 100 -Ь4,329
4-5,3823 а ф £ 3 = 2,373- со, + SO, + о. c+-s 20,9-Р(СО2 + SO,); N, 3,785 - 0, 38 (2) (3) (4) (5) со, 8С При неполном сгорании д. б. удовлетворены следующие семь уравнений: со, + so, -f со -ю, -ь N, = 100; (6) со Q, = 56,7 - с со,+ со н- Р - 2,373 c + s 0,6045 + [V содержание хих газов. Все дятся путем совместного решения вышеуказанных ур-ий. При этом нужно иметь в виду, что ур-ие (10) дает величину Z, кото-ран м. б. названа характеристикой неполноты сгорания. В эту ф-лу входит коэфф./9, определяемый по ф-ле (8). Так как коэфф. /3 зависит только от химического состава топлива, а последний в процессе сгорания топлива все время меняется за счет постепенного ококсования топлива и неодновременного выгорания его составных частей, то величина Z М9жет дать правильную картину протекающего в топке процесса только при условии, что величины (COj-f + so2) и (со2 -Ь so2 -f- о2) суть результат анализа непрерывно берущихся средних проб за определеяный достаточно долгий промежуток времени. Судить о неполноте сгорания по отдельным единичньш пробам, взятым в какой-нибудь произвольный момент, никоим образом нельзя. Зная состав продуктов сгорания и элементарный анализ топлива, можно по нижеследующим ф-лам определить объем продуктов сгорания, условно отнесенный к 0° и 760 мм ртутного столба. Обозначив через Vn.o. полный объем
|