
 |
|
|
Литература --> Водородные ионы в производстве ватъ взятое количество воды, сохраняя давление постоянным, то t° воды повышается, и при нек-рой величине ее начинается испарение воды. При нагревании воды уд. объем ее, теоретически говоря, несколько увеличивается (по крайней мере, начиная с 4°, 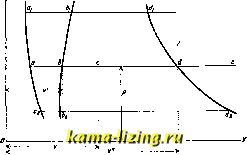 Фиг. 1. т. е. OTt° наибольшей плотности воды). Поэтому точки начала испарения при разных давлениях (pg, р, Pi) будут лежать на некоторой другой кривой bjbbi. Фактически это увеличение объема воды при повышении t° незначительно, и потому при невысоких давлениях и t° можно принимать уд. объем воды за постоянную величину. Уд. объемы воды в точках bg, Ь, обозначаются соответственно через vi, v, v[\ кривая ЪфЬ называется нижней предельной кривой. Температура, при которой начинается испарение, определяется тем давлением, под к-рым находится нагреваемая вода. За все время испарения эта t° не изменяется, если давление остается постоянным. Отсюда следует, что° насыщенного пара есть функция только давления р. Рассматривая какую-либо линию, изображающую процесс испарения, например bed, видим, что объем смеси пара и жидкости в процессе испарения возрастает по мере увеличения количества испарившейся воды. В нек-рой точке d вся вода исчезает, и получается чистый пар; точки d для разных давлений образуют некоторую кривую ddd, которая назьшает-ся верхней предельной кривой, или кривой сухого насыщенного пара; пар в этом состоянии (когда только что закончилось испарение воды) называется сухим насыщенным паром. Если продолжать нагревание после точки d (по напрайлению к нек-рой точке е), оставляя давление постоянным, то 1° пара начинает повышаться. В этом состоянии пар называется перегретым. Таким образом получаются три области: правее линии dddj,-область перегретого пара, между линиями &1662 и dadz-область насьпценного пара и левее линии bib&g-область воды в жидком состоянии. В какой-либо промежуточной точкес имеется смесь пара и воды. Для характеристики состояния этой смеси служит количество х содержащегося в ней пара; при весе смеси в 1 кй (равном весу взятой воды) эта величина х называется пропорцией пара в смеси, или паросодержанием смеси; количество воды в смеси будет равно (1-ж) кг. Если v ж* 1кг-уд. объем сухого насыщенного пара при темп-ре t и давлении р кг/см*, а объем воды при тех же условиях v, то объем смеси v найдется по формуле: V - XV + (1 - x)v, V = x{v - v) + v. Объемы v viv, a следовательно, и их разность v -v суть функции давления р (или температуры t). Вид функции, определяющей зависимость р от для водяного пара, очень сложен; существует много эмпирическ. выражений для этой зависимости, которые все, однако, годятся лишь для нек-рых ограниченных интервалов независимой переменной t. Реньо для t° от 20 до 230° дает ф-лу: Ig ) = а-& * + 80 - с/9 где а = 6,2640348, Ig а = 0,998343862 -1, Ig iff = 0,994049292 -1, Ig 6 = 0,6924351, Ig с = 0,1397743. В настоящее время часто пользуются формулой Дюпре-Герца (Dupre-Hertz) [}: Igp = Л - mlg Г - , где А;, m и п-постоянные. Шюле [] дает эту ф-лу в след. виде: lgPe = - -, при чем для t°: а) между 20 и 100° Ig р = 5,9778 - (р-7-в кг/см, Т-абсолютная темп-ра пара); б) между 100 и 200° lgp = 5,6485-?У; в) между 200 и 350° lgp = 5,45142- у Характер кривой давления р пара как функции температуры виден на фиг. 2. 2010,8 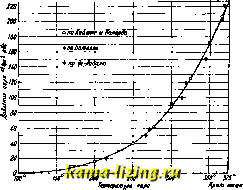 Фиг. 2. В практике пользуются непосредственно таблицами, дающими связь между р vl t. Таблицы эти составляются на основании точных опытов [*, 6 в] Для нахождения удельных объемов сухого насыщенного пара имеется теоретически выводимая ф-ла Кла-пейрон-Клаузиуса.Можно пользоваться также эмпирической формулой Молье []: г; р= 1,7325. Количество тепла q, необходимое для нагревания 1 кг воды от О до t° (начала испарения), выражается так: t q dt, о где с-теплоемкость воды, в широких пределах мало отличающаяся от единицы; поэтому пользуются приближенной формулой: qt. Однако уже Реньо убедился в заметном возрастании с при высоких темп-рах и дал для q выражение: q = t + 0,000022 -f 0,00000033, В новейшее время для с даются такие данные (ф-ла Дитеричи): с = 0,9983 - 0,0001037 + 0,0000020732. Для средней теплоемкости в интервале от О до t° дано выражение: = 0,9983 - 0,00005184 -f 0,0000006912 . Несколько отклоняются от этой ф-лы данные опытов германского физико-технич. института [в], наблюдения которого дают сле-дуюпще значения с:
Для обращения в пар воды, нагретой до темп-ры , нужно еще затратить нек-рое количество тепла г, к-рое называется скрытой теплотой испарения. В настоящее время эту затрату теплоты разделяют на 2 части: 1) теплоту гр, идущую на внешнюю работу увеличения объема при переходе воды в пар (внешнюю скрытую теплоту испарения), и 2) теплоту д, идущую на внутреншою работу разъединения молекул, происходящую при испарении воды (внутреннюю скрытую теплоту испарения). Внешняя скрытая теплота испарения ф = Ap{v - v), где --тепловой эквивалент механической работы. Таким образом г = Q + Ap{v - v). Для г дается следующая ф-ла (основанная на опытах германского физико-технического института): г = 610,3-0,7Ш. Полная теплота испарения А, т. е. количество тепла, необходимое для обращения воды, взятой при 0°, в пар при темп-ре t, равна, очевидно, q-\-r. Реньо дал для Я следующую формулу: А = 60б,5-Ь0.305<; эта формула дает результаты, близкие к новейшим опытным данным. Шюле С] дает: Я = 608+ 0,311. Внутренняя энергиям воды при 0° принимается равной нулю. Для нахождения приращения ее при нагревании воды нужно выяснить характер изменения удельн. объема воды при изменении давления и т. е. вид кривых ami и ЪфЬ (фиг. 1). Про- стейшим предположением будет нринятие этих линий за прямые, и притом совпадающие друг с другом, т. е. принятие уд. объема воды V за постоянную величину, не зависящую ни от давления, ни от t°(=0,001 мкг). При этом предположении вся теплота, идущая на нагревание жидкости, т. е. q, идет на повышение внутренней энергии (так как внешней работы при этом нагревании не совершается). Это предположение годится, однако, только для сравнительно невысоких давлений (таблицы Цейнера даны до давлений в 20 кг/см). Сов{)еменные таблицы (Молье и др.), доходящие до критическ. давления (225 кг/см) и t° (374°) не могут, конечно, игнорировать изменения объема воды (уд. объем воды при критическ. давлении и критическ. темп-ре равен 0,0031 м/кг, т. е. в три с лишним раза больше, чем при 0°). Но Стодола [8] и Кноблаух показали, что приведенная у нас вьшге ф-ла Дитеричи для величины q дает именно величины изменения внутренней энергии (а не величины q); Cal POO 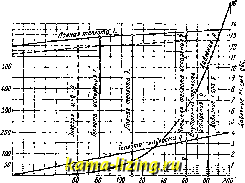 го io Температура Фиг. 3. впрочем, разница между этими величинами до давления в 80 кг/см незначительна. Поэтому полагаем для воды внутреннюю энергию равной теплоте жидкости: u = q. За период испарения внутренняя энергия повышается на величину внутренней скрытой теплоты испарения д, т. е. энергия сухого насыщенного пара будет: и = q -\- q (фиг. 3). Для смеси с пропорцией пара х получим следующее выражение: и = q{l - X) + {q + q)x = q + xq. Зависимость теплоты испарения и давления от t° графически дана на фиг. 3. Молье ввел в технич. термодинамику тер-модинамич. функцию г, определяемую уравнением г = м + APv и называемую теплосодержанием. Для скеси с пропорцией пара X это даст: i = q-{- XQ + АР x{v - v) + v], или, после приведения: г = g + £сг + APv; для воды (£с=0) получается: i - q-\- APv\ для сухого насыщенного пара: г = 2 +г + APv. Величина произведения APv очень мала по сравнению даже с величиной q (и тем более по сравнению с величиною q-r=k); поэтому можно принять г q; г g -j- г. В таблицах Молье даются поэтому не величины g и А, а величины i и г в функции р или t°. Энтропия насыщенного пара находится по своему дифференциалу ds выражение dQ для всех тел имеет вид: dQ = du + APdv. Для насьцценного водяного пара ds = dq + APdv Первый член представляет собою приращение энтропии воды при ее нагревании, второй член-приращение энтропии смеси во время испарения. Полагая dq + APdv получим ds = ds + d или, интегрируя: Заметим, что при вычислении s изменением уд. объема v обыкновенно тоже пренебрегают и полагают s= . Для решения всех вопросов, касающихся насыщенных паров, пользуются таблицами. В прежнее время в технике находили применение таблицы Цейнера, в настоящее время они являются устарелыми; можно пользоваться таблицами Шюле, Кноблауха [] или Молье [ь*]. Во всех этих таблицах давления и t° доведены до критич. состояния. В таблицы включены следующие данные: t° и давление насыщенного пара, уд. объем воды и пара и уд. вес пара, энтропия жидкости и пара, теплосодержание воды и пара, полная скрытая теплота испарения , внутренняя энергия, внутренняя и внешняя скрытая теплота. Для некоторых вопросов (касающихся, напр им., конденсаторов) составляются специальные таблицы с мальпли интервалами давлений или температуры [°]. Из всех изменений пара особенный интерес представляет адиабатическое изменение; оно м, б. изучено по точкам. Пусть дана (фиг. 4) начальная точка 1 адиабаты, определяемая давлением Pi и пропорцией пара Xi, требуется определить состояние пара в точке 2, лежащей на адиабате, проходящей через точку 1 и определяемой давлением Ра- Для нахождения Жа выражают условие равенства энтропии в.точках i и 5: *1 + Yi ~ *а + i- В этом ур-ии величины s, 2 и находятся по данным давлениям Pi и ра, пропорция пара Xi задана, и неизвестен толь- 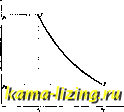 Фиг. 4. ко х. Удельный объем в точке 2 определится по формуле: V, = osivi - Га) + v;. Величины га и v находятся из таблиц. Внешняя работа рассматриваемого адиаба-тич. изменения находится по разности внутренних энергий вначале и конце изменения: AL = Ui-u = qi + XiQi - Sa - х. Для упрощения вычислений часто пользуются при изучении адиабатического изменения эмпирич. ур-ем Цейнера, который выражает адиабату как политропу: Показатель степени fi выражается через начальную пропорцию пара Xi так: = 1,035-Н0,1а?1. Ф-ла эта применима в пределах от 1=0,7 до Ж1=1. Адиабатич. расширение при начальной высокой пропорции пара, выше 0,5, сопровождается обращением части пара в воду (уменьшением ж); при начальных пропорциях пара, меньших 0,5, адиабатич. расширение сопровождается, наоборот, испарением части воды. Формулы для остальных случаев изменения насыщенного пара находятся во всех учебниках технической термодинамики [ ]. II. Перегретый пар. Внимание к перегретому пару привлечено было еще в 60-х годах прошлого столетия в результате опытов Гирна [*], показавших значительную выгоду при применении перегретого пара в паровых машинах. Но особенного распространения перегретый пар достиг после создания В. Шмитом особых конструкций перегревателей специально для получения пара высокого перегрева (300-350°). Эти перегреватели нашли широкое приложение сначала (1894--95 гг.) в стационарных паровых машинах, затем в паровозных машинах и в 20 веке-в паровых турбинах. В настоящее время почти ни одна установка не обходится без применения перегретого пара при чем перегрев доводится до 400- 420°. Для возможности рационального применения столь высокого перегрева самые свойства перегретого пара были тщательно изучены. Первоначальная теория перегретого пара дана была Цейнером; она опиралась на немногочисленные опыты Реньо. Ее основные положения: 1) особый вид ур-ия состояния, отличающегося от уравнения для идеальных газов добавочным членом, к-рый является функцией только давления; 2) принятие для теплоемкости Ср при постоянном давлении постоянного значения: 0=0,48. Оба эти предположения не подтвердились в опытах над свойствами перегретого пара, произведенных в более широких пределах. Особое значение получили обширные опыты Мюнхенской лаборатории технич. физики, начатые около 1900 г. и продолжающиеся и в настоящее время []. Новая теория перегретого пара была дана в 1900-1903 гг. Каллендером в Англии и Молье в Германии [], но и она не явилась окончательной, так как выражение для теплоемкости при постоянном давлении, получаемое из этой теории, не вполне согласуется с новейшими опытными данными. Поэтому появился
|