
 |
|
|
Литература --> Производство жидкого угля большей компактности 3. вьшолняют иногда в форме пробки крана (фиг. 5). Прямолинейно-возвратное движение 3. заменяется тогда качанием его ок. оси цилиндрического зеркала. Этого типа 3. называются кранами. При большом давле-шш рабочего тела передвижение коробчатого 3. или крана требует большого усилия, вследствие того что между 3. и его зеркалом возбуждается значительное трение. Последнее будет тем больше, чем больше давление рабочего тела на 3. В целях разгрузки 3. от давления рабочего тела 3. вьшолняют в виде тела вращения, меридиональное сечение которого представляет собой продольное сечение плоского 3. Принцип действия 3. от этого нисколько не меняется, а усилие, необходимое для его перемещения, получается 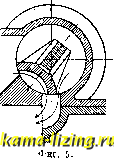 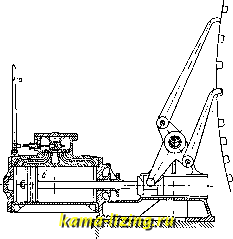 Фиг. 6. значительно меньшим. 3. может приводиться в действие от руки или от какого-либо автоматически действующего механизма, при чем характер движения 3. находится в соответствии с назначением его работы. 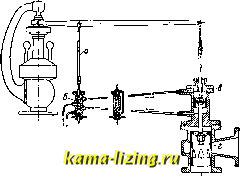 Фиг. 7. На фиг. 6 дан пример ручного привода к 3. Движением рукоятки а можно заставить поршень б двигаться под действием пара вправо или влево и т. о.приводить в действие механизм для вращения тяже- лого маховика. На фиг. 7 показан пример автоматич. привода 3. от регулятора паровой турбины. При изменении числа оборотов турбины муфта регулятора пойдет вверх или вниз и потянет соответственно за  Фиг. 8. собой, при П0М0ПЦ1 рычага а, золотник б, к-рым распределяется действие рабочего масла на поршень в сервомотора, непосредственно переставляющего тяжелый дроссельный клапан г турбины. В паровых поршневых машинах, в которых прямолинейное движение поршня помощью кривошипного механизма преоб-разовьшается во вращательное движение коленчатого вала, 3. применяется в качестве распределительного органа и приводится в движение, в соответствии с движением поршня, от коленчатого вала машины при помощи кривошипа или эксцентрика, к-рый посажен на этом валу (фиг. 8). Конструктивное описание и исследование движения 3., осуществляющего рабочий процесс паровой машины, см. Нарораспре-делеиие (паровых Л1а-шин). Если паровая машина имеет специальное назначение, напр., соединена непосредственно с каким-либо орудием, то движение 3. ставится в прямую зависимость от действия этого-орудия. На фиг. 9 изображен привод 3. а or бабы парового молота, а на фиг. 10-золотник а приводится в двилсение от штока. 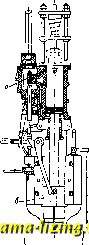
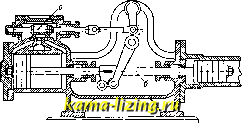 Фиг. 10. б, соединяющего паровой и водяной поршни в прямодействующем паровом насосе. золото Лит.: П о л ь г а у 3 е н А., Поршневые паровые машины, М., 1927; Д у б б е л ь Г., Паровые машины и паровые турбины. Руководство и справочная книга для студентов и конструкторов, пер. с последнего нем. изд., Ленинград, 1926; Н а е d е г Н., Die Dampf-maschinen u. Dampfturblnen, В. 3-Steuerungen d. Dampfmaschinen, 9 Auflage, Wiesbaden, 1910; D u b-bel П..Die Steuerungen d. Dampfmaschinen, 3 Auflage, Berlin, 1923. П. Соловьев. ЗОЛОТО, Au, ат. вес 197,2, металл второй подгруппы (Си, Ag, Au) первой группы периодич. системы. По своим свойствам 3. образует переход от тяжелых платиновых металлов (осмий, иридий, платина) к ртути (см. Периодическая сист..ема). Чистое 3. окрашено в желтый цвет, а в виде очень тонких листов просвечивает синевато-зеленым цветом. Кристаллы 3. относятся к кубич. системе. 3. тверже олова и мягче цинка (твердость 2,5-3). При своей мягкости и большой тягучести 3. отличается зпачите.чьной механич. прочностью. Проволока сечением в 1 м.м разрывается нри нагрузке в 27 кг. Уд. в. литого 3. 19,3 (при 18°), атомный объем 10,2; 3. относится к элементам с наименьшим атомным объемом. Уде.тьная теплоемкость 3. между О и 100° равна 0,031; плавится 3. при 1 063°; при нагревании в вакууме до 1 070° заметно улетучивается; t°Kiin. 3. (при 760 мм) 2 530° (Муассан). В э.тектрич. печи уда.яось в течение 6 мин. перегнать 60 г 3. Теплота испарения 3. равна 64,5 Cal на грамм-атом. 3.-превосходный проводник тепла и электричества. Если принять э.пектропроводность серебра равной 100, то электропроводность 3. будет -76,7. Электрическое сопротивление 3. равно 0,24-10 * й-сж; 3. показывает при температуре жидкого гелия явления сверхпроводимости. В химич. отношении 3. характеризуется прежде всего относительно малым сродством к другим элементам. При обыкновенной t° только хлор и бром непосредственно соединяются с 3.; при высокой Г 3. образует соединения также с фтором, серой, фосфором, мышьяком и пек-рыми другими метал.лои-дами. Наилучшими растворите.яями д.ля 3. являются смеси, выделяюшие хлор, напр. царская водка, и.ли перекиси, смешанные с соляной к-той. Небольшие количества 3. растворяются также в смесях, выделяющих кислород, напр. КМп04-ЬН2804 (конц.) или HNO3+H2SO4. Единственной к-той, растворяющей 3. самостоятельно, яв.ляется селеновая кислота H2Se04, обладающая невидимому высоким окислительным потенциалом. На аноде 3. растворяется как в крепких кис-.лотах, так и в щелочах, при чем присутствие ионов, способных образовать с ионами 3. комп.лексы, значительно увеличивает анодное растворение. О растворимости 3. в растворах цианистого калия и ртути см. ниже. Золота соединения. 3. образует два рода соединений, в которых оно одновалентно (закисные соединения АпХ), или трехвалентно (окисные соединения AuXg); однако, существуют повиди-мому и соединения двухвалентного золота. Характерной особенностью соединений 3. является сильно выраженное стремление к образованию комплексов с различными анионами. В этом отношении 3. прояв.ляет сходство с платиной. Соединения 3. отличаются весьма малой прочностью, что видно из следующих данных теплот образования Q (в Cal на граммолекулу): Вещество Q Вещество Q KC1.......105,6 АНзОз......-12,3 АиВг......-0,08 AuCU......4-22,8. AnJ.......-5,5 По современным взглядам такое слабое сродство 3. зависит в первую очередь от большого значения энергии ионизации атома 3. (см. Валентностъ). Хлорное 3., АиС1з, получается действием хлора, х.лорной воды или царской водки на 3. Оно образует темнокоричневую кристаллическую массу; при нагревании до 185° хлорное 3. отдает / своего хлора, а при слабом прокаливании распадается по.л-ностыо на составные части. 100 г воды растворяют 68 г хлорного 3. Раствор не содержит ионов Au , а дает с водой комплексную кислоту ClgAuOHo, образующую соли, например ClgAuOAga. При действии гипосульфита на AuClg образуется растворимая в воде бесцветная двойная серноватистая соль 3. и натрия, т. н. соль Фордо и Желиса МазАи(820з)-2 HgO, сладкого вкуса, не восстанавливаемая ни FeS04 ни щавелевой кислотой; применяется в медицине и в фотографии. Равным образом и с солями сернистой к-ты Ап образует двойную соль: КазАи(80з)2=АиЯа(80зКа)2. Золотохлористоводородная к-т а, HAUCI4, кристаллизуется с 4 молекулами воды в желтых иглах, расплывающихся на влажном воздухе. Вещество это образуется при прибавлении соляной к-ты к раствору AuClg или при действии на 3. реактивов, выделяющих хлор, в присутствии соляной к-ты. С целым рядом неорганич. и органич. оснований зо.лотохлористоводородная к-та даетсо.ли-х лороаураты, напр. KAUCI4, Ca(AuC 14)2-61120. Хлористое 3., AuCl, по.лучается в виде желтоватого порошка при нагревании хлорного 3. до 200°. Вода раз.лагает хлористое 3. гю схеме 3 AuCl -> 2 Au + AuCla . Цианистое 3., AuCN, отличается способностью давать относите-лыш прочные комплексные соли; с цианистым калием, напр., образуется соль [Au(CN)2]K, представляющая бесцветные кристаллы, легко растворимые в воде. Соль эта получается также при действии раствора цианистого калия и воздуха на мелкораздробленное 3.: 2 Au -Ь 4KCN + Н2О -Ь о -> 2 [An (CN),] К -Ь 2К0Н и при анодном растворении 3. в растворе цианистого калия (см. нилсе). Гидрат окиси 3.-ф-лы Аи(ОН)з и АиО(ОН)-имеет амфотерный характер, образуя соли как с к-тами, так и с основаниями. Если к раствору хлорного 3. прибавить едкого кали, то сперва получается осадок, к-рый в избытке щелочи вновь растворяется. При упаривании в вакууме выделяются желтые кристал.лы аурата калия, КАиОа-ЗНаО, дающие при приливании азотной к-ты бурый порошок окиси 3.-AU2O3: 2 к АнО. 3 Н.О + 2 HNO3 = 2 KNO3 + AU2O3 -t- 4 НО . Ана.логичным л-се путем, но только через аурат магния с последующим извлечением магния слабой азот1юй к-той, был получен гидрат окиси 3., Аи(ОЫ)з, в виде бурого порошка. Аи(ОН)з теряет воду уже при 100° и дает окись 3., разлагающуюся при дальнейшем нагревании на 3. и кислород. 3 а к и с ь 3., AUaO, образует фиолетовый порошок, нерастворимый в воде. Чувствительной реакцией на соединения 3. является действие восстановителей, выделяющих 3. в коллоидном состоянии из разбавленных ])астворов. Раствор, содерлсащий, например, 1 ч. 3. в 64 ООО ч. жидкости, принимает при приливании к нему раствора сернокислой закиси железа ясно фиолетовую окраску. П р и м е н е н и е соединений 3. Хлорное 3. находит применение в фотографии, Дч1я золочения, для рисования по стеклу и фарфору, для изготовления золотого пурпура и в качестве лекарственного средства. Аурат натрия часто применяется для таких же целей, как и х.чорпое 3., особенно в фотографии для тонирования. Лит.: Менделеев Д. И., Основы химии, 9 изд., т. 1-2. М.-Л., 1927-28; Handb. d. anorganischen Cliemie,hrsK. v.R. Abegg u. Fr. Auerbacb, B. 2, Abt. 1, Lpz., 1908; M e 1 1 о r .1. W., A Comprehensive Treatise on Inorganic a. Theoretical Chemistry, v. 3, L., 1923; Landolt-Bornstein, Physlkalisch-che-mische Tabellen, В., 1923. И. Казарновский. Металлургия золота. Металлургия 3. имеет своей задачей извлечение 3. из его руд. В настоящее BpeMii это извлечение осуществляется следующими основными процессами: 1) амальгамацией, 2) цианированием и 3) пирометаллургич. пе-])еработкой (см. Медь и Свинец) колчедани-стых концентратов и руд. Кроме этих процессов, большое значение в металлургии 3. имеют вспомогательные процессы обогащения, в частности введенный в последнее время процесс флотации. Широко распространенный в прежнее время процесс хлоринации, применявшийся к извлечению 3. из руд (обработка хвостов) посте амальгамации, в иа-стоящоо время совершенно вытеснен цианированием. 3., получаемое вышеуказанными способами, содержит всегда ряд примесей (серебро, медь, л-селезо, металлы платиновой группы и др.). Очистка 3. и отделение от него ценных примесей (серебро, мета.члы платиновохЧ группы) производятся особым процессом-а ф ф и н а ж е м. Извлечение 3. из руд путем амальгамации. Процесс амальгамации и условия его ведения. Амальгамация руд, содержащих 3. и серебро, является весьма старым и распространенным процессом. 3. дает с ртутью два соединения (AuHga и AujIIg); ртуть образует твердый раствор в 3. (предельной концентрации-16% ртути в 3.). Растворимость 3. в ртути весьма невелика и при обыкновенной Г (20°) достигает 0,2%. Амальгамы 3. представляют смеси, в к-рых соединение 3. с ртутью диспергировано в растворе 3. в ртути. Амальгамы 3., получаемые при амальгамации зо.чотых руд, обыкновенно содержат, кроме 3. и ртути, таюке и другие элементы в виде соединений с ртутью. Амальгама, получаемая после отжимки избытка ртутиотжидкой амальгамы, содержит в среднем на 2 весовые части ртути 1 часть 3. Амальгамы с мелким 3 . т. Э. т. Vlir. дают после отжимки более высокое содерлсание ртути, и наоборот, т. к. процесс диффузии ртути в частицах крупного 3. ие полностью доходит до центра частиц. Кроме того, металл с большим содержанием серебра обычно дает амальгамы с более высоким содерлсанием ртути. В отжатой избыточной части ртути содержится по весу ок. 0,1--0,2% растворенного в ней 3. (при весьма мелком 3. или недостаточной п.чотности фильтрующей среды) и выше. Кроме Аи, неносредственно ама.чьгамиру-ются Ag, Си, РЬ, Zn, Cd, Bi, Sn, Na и К и при i° 15-20° (но не на холоду) As и Sb; косвенным путем (электро.чиз, натриевая амальгама и др.) амальгамируются Fe, Ni, Со, Сг, А1 и Pt. Химически чистая ртуть слабее амальгамирует, чем ртуть, содерлсащая в растворе Аи и Ag и небольшие количества Zn, РЬ и Си; при бо.чее высоком содержании посчедних металлов ртуть становится мало пригодной для амальгамации. Потери ртути и 3. при амальгамации руд происходят вследствие: 1) присутствия в руде колчеданов, особенно в случае наличия в составе ее As и Sb; 2) образования легких ама.чьгам (напр. модной); 3) систематич. загрязнения ртути; для очистки ее взбалтывают с соляной или азотной к-той или перегоняют под известью; 4) педостат1са или больнюго избытка воды, а также загрязнения ее в процессе амальгамации (попадание в воду машинного масла); 5) образования лсе.чезной- ама.чьгамы (в случае присутствия меди осколки и тонко измельченные кусочки лселеза, стали и чугуна покрываются слоем цементной меди, с поверхности амальгамируются и задерлсиваются в амальгаме); 6) из-оытка ртути (образуется слишком жидкая амальгама); 7) недостатка ртути (хрупкая амальгама); 8) недостаточной длины и слишком большого уклона шлюзов, на которых происходит амальгамация; 9) отсутствия и недостатка .човушек; 10) слишком быстрого измельчения руды (при внутренней амальгамации); 11) улетучивания ртути при от-парке амальгамы. При нормальном ведении процесса общая потеря ртути не превышает 0,7-1,0%. Способы ведения амальгамации и аппаратура. Способы ведения амальгамации распадаются на две основные группы: 1) внутренняя амальгамация, когда процесс производится внутри измельчающих аппаратов, и 2) наружная, или внешняя, амальгамация, когда процесс производится вне изме.тьчающих аппаратов (амальгамация на досках, амальгаматорах и т. д.). Амальгамация руд на современных з-дах, на к-рых установлен последующий процесс цианирования, ведется почти исключительно в целях извлечения крупного свободного 3. на амальгамированных досках или в це.чях вторичной обработки в амаль-гамационных бочках богатого 3. материала, снятого с плисовых шлюзов. Особое значение амальгамация золотых руд приобретает на небольших предприятиях в Сибири и особенно на Дальнем Востоке при разработке месторонсдений зо.чотых руд, залегающих в зоне окислешхя. В этих стча-ях успех этого пропесса объясняется тем, что
|
|||||||||||||||||