
 |
|
|
Литература --> Производство газовых тканей ГИДРИДЫ, соединения водорода с другими элементами. Несмотря на классич. одновалентность водорода, соединения его отличаются большим многообразием. Объясняется это, с одной стороны, амфотерным (см.) характером водорода, т. е. свойством давать, Соле-образиые гидриды К л а с с и ф и к а ц и я гидридов. Металлоподобиые гидриды Летучие гидриды
Редкие земли. В зависимости от характера партнера, то положительные (Н*), то отрицательные (Н) ионы, а с другой-способностью водорода входить и в гомеополярную связь. Наконец, малые размеры атома водорода позволяют ему проникать в кристаллические решетки металлов (напр., платины, палладия) с образованием систем, повидимому, промежуточных между растворами и химическими соединениями. В соответствии с этим Г. можно разделить на три группы: летучие, солеоб-разные и металлоподобиые. Водородные соединения элементов четвертой, пятой, шестой и седьмой групп и бора образуют группу летучих Г. Вещества эти (например: СН4, SiH, SnH4, NH3, РН3, Н2О, H2S, HF, HCl, HJ, BjHe) при обыкновенной температуре обычно газообразны, а в твердом состоянии обнаруживают наличие молекулярных решеток. Состав простейших типов определяется нормальн. валентностью. Прочность этих соединений увеличивается от углерода к фтору, а в одной и той же вертикальной группе падает с возрастанием атомного веса. Например, метан, СН4, более устойчив, чем SiH4, SnHi, PbH4. Ни в твердом, ни в жидком состоянии эти соединения не проводят электрического тока. Совершенно иные свойства обнаруживают соединения водорода с щелочными и щелочноземельными металлами (например, NaH, СаНз), получаемые непосредственно нагреванием соответствующего металла с водородом. Вещества эти обладают ярко выраженным солеобразным характером, при чем водород играет роль аниона. Кристаллы их бесцветны и прозрачны и построены из ионов-образуют ионные решетки. От большинства других солей эти вещества отличаются неустойчивостью по отношению к химич. агентам. Они являются сильными восстановителями. Вода разлагает их по схеме: Call, + 2lIaO = Са(ОН)з + гН. Гидрид кальция имеет техническое значение в качестве источника получения водорода, i Особенность металлоподобных Г. состоит в том, что поглощение водорода металлом идет непрерывно, при чем образуется всегда единственная твердая фаза, т. е. раствор. Метал.пическ. характер при этом сохраняется (электропроводность металла при поглощении водорода почти не меняется). Кристаллич. решетка металла обычно слегка раздвигается, но тин ее сохраняется (за исключе1шем 1шкеля). Так как атомы металла в узлах решетки не меняют своего распо-лоясения по отношению друг к другу, то водороду в металле надо приписать некоторую подвижность, благодаря чему разность концентраций его выравнивается. Относительно состояния водорода в металлоподобных Г. взгляды расходятся. Ряд фактов, в частности, химич. и электрохимическая активность водорода, растворенного в металлах (см. Катализ, Гидрирование), и зависимость поглощаем, количества от давления указывают на атомное состояние, однако, в стучае палладия Кену удалось сделать вероятным и наличие положительных ионов водорода. Лит.: Paneth F. и. Rabinowitsch Е., в , 1925, В. 58, р. 1138; Н li t t i g S., Z. ang. Ch. , 1926, 1, p. 67; Handb. d. Physik, hrsg. v. H. Geiger u. K. Scheel, B. 24, p. 517, в., 1927. И. Казарновский. ГИДРИРОВАНИЕ, гидрогенизация, присоединение водорода к простым и сложным химич. телам. Только немногие из элементов обладают свойством непосредственно реагировать с газообразным водородом. Подавляющее же большинство сложных химических тел, из к-рых наибольший интерес с точки зрения Г. представляют органич. соединения, могут связывать водород только в присутствии катализаторов. Т. о., под Г. чаще всего понимают каталитич. связывание водорода органич. соединениями. Вместе с Г. целесообразно рассматривать также и каталитич. восстановление (дезоксидацию), так как оба процесса в одинаковой степени связаны с явлениями активирования и практически достигаются тождественными методами. Явления Г. относятся к области гетерогенного катализа, и решение вопроса о механизме Г. неразрывно связано с выяснением общих каталитич. проблем (см. Катализ). В истории катализа крупную роль сыграла т.н. теория промежуточных соединений. Применительно к Г. эта теория наиболее полно развита французским химиком Сабатье. Он считает, что на поверхности катализирующего металла при взаимодействии с водородом образуются малоустойчивые, по поддающиеся стехиометрич. учету соединения, которые способны отдавать свой водород ненасыщенным или содер-и-сащим кислород веществам в активной (но всей вероятности, атомной) форме. Так. обр. каталитич. активность, по Сабатье, зависит от двух важных моментов: от способности данного металла образовывать с водородом гидриды и от степени устойчивости последних, т. е. от большей или меньшей степени легкости отдачи ими атомного водорода (см.). Так, например, Г. этилена может быть вы-ралсено уравнениями: 2 Ni + Нг = Niji; Ni.Hs + СгН, = СзН, + 2 Ni. Действительно, некоторые металлы, являющиеся катализаторами в процессах Г. (напр. палладий), обладают свойством в мелкораздробленном состоянии поглощать водород. Однако, вопрос о том, образуются ли при этом химические соединения или системы типа твердых растворов, до сих пор нельзя считать вполне выясненным. Рентгеноскопич. исследования металлов, зарязкенных водородом, и измерения теп.лот адсорбции пе дали вполне однозначных результатов [1J. Тем не менее, в некоторых случаях химич. путем уда.лось доказать, с большей или меньшей степенью достоверности, образование гидридоподобных металлич. соединений. Так, напр., Шленк [j из водорода и никеля получил соединение, отвечающее ф-ле NiHa и обладающее гидрирующим действием. В связи с углублением и расширением областей катализа, доступных детальному изучению, выявилось много новых моментов, частью физич., частью же химич. порядка, показавших, что гидрогенизацион-ные явления протекают значительно сложнее, чем это представляется теорией проме-зкуточиых соединений в той форме, в к-рой она была дана Сабатье. Бо.льшое значениз для Г. имеют явления адсорбции и связанная с последними ориентировка адсорбированных молекул, их деформация и др. яв.ле-ния, имеющие место в поверхностном слое. Вместе со старой теорией промежуточных соединений потерпела крушение и чисто физическая теория Г., согласно к-рой катали-тич. активность мелкораздробленных метал.лов вызывается исключительно физическими ({)акторами-сильным сжатием поглощенных реагирующих веществ и происходящими при этом местными разогреваниями. Первые наблюдения в области каталитич. восстановления были сделаны в начале 19 в. Деви и практически использованы Деберей-нером (водородное огниво) над соединением кислорода и водорода под влиянием платины. В 1838 г. КульМап нашел, что при нагревании азотной к-ты или ее паров вместе с водородом в присутствии платиновой черни происходит образование аммиака. Каталитич. свойства платины были да.лее использованы Коренвиндером для соединения иода и водорода и Дебусом для восстановления синильной к-ты в метиламин. Зайцев с успехом применил порошкообразный палладий для восстановления 1штробензола в анилин. В 1874 г. де-Вильде провел Г. ацетилена в этилен и далее-в этан.Широкое применение Г. начинается с 1897 года, после того как Сабатье и Сандерен разработали метод гидрирования органическ. соединений в парообразном состоянии в присутствии мелкораздроб-.ленных металлов, главным образом, никеля. Дальнейшее развитие гидрогенизационного катализа связано с именами Фокина, Ипатьева, Вильштеттера, Пааля, Скита и Шретера. В зависимости от того, в каком аггрегат-ном состоянии прпменяется гидрируемое вещество-в виде пара (газа) или жидкости (раствора), различают два метода Г. 1)Г. в парообразном состоянии. Этот метод состоит в том, что через слой ката.лизатора, которым могут служить металлы: никель, кобальт, железо, медь и платина, пропускают пары гидрируемого вещества вместе с водородами. Наибольшей ак-тиыюстью обладает нике.ль; затем следуют по порядку: кобальт, платина, железо и медь. Однако, на практике почти всегда пользуются никелем и в редких- случаях-медью (напр., для восстановления нитросоедипе-ний). Иногда Г. происходит уже при обыкновенной темп-ре; чаще же всего оптимальная t° лежит между 150 и 200°. Схема расположения частей лабораторной аппаратуры показана на <\тт. 1. Водород, получаемый при 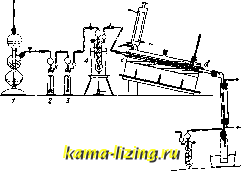 Фиг. 1. помощи аппарата Киппа 1, проходит через промывные трубки 2,3, сосуд с гидрируемым веществом 4 и затем в трубку cd с катализатором. Для выполнения Г. большое значение имеет способ приготовления никелевого катализатора. Он обычно получается восста-нов.лением в токе водорода окиси, гидроокиси или основного карбоната никеля. Активность катализатора в значительной степени зависит от t° восстановления: чем она ниже, тем активность бо.льше. Так, напр., никель, восстановленный из окиси при t° выше 350°, уже непригоден для Г. ароматическ. соединений, а выше 450°-почти лишен заметного каталитич. действия. Вместе с каталитическ. активностью растет также свойство катализатора вызывать побочные реакции (распад, перегруппировки, отщепление воды). Так, напр., фено.л при Г. в присутствии никеля, восстапов.леиного при 250°, превращается в циклогексан (большая часть), циклогехссен и циклогексано.л; при Г. ие никелем, приготовленным при 310°, цик.логексан почти вовсе пе образуется. Присоединение водорода к различным хюиасыщенным группам происходит с различной скоростью, и потому, выбирая ту или иную темп-ру восстанов.ле-ния окиси никеля, т. е. получая катализатор раз.личной степени активности, можно достигнуть частичного Г. Для увеличения ак-тивп. поверхности катализатора никель иногда отлагают па различных веществах (носителях). Д.ЛЯ этой цели применяют: пемзу, кизельгур, глину, различнью сорта гидро-снликатов алюминия и магния, животный или костяной уголь, липовый, сахарный уголь, а также сульфат бария, окись алюминия и т. п. индифферентные вепдества, выдерживающие высокую 1°. Хлор, бром, иод, фосфор, мышьяк, сера и сернистые соединения вызывают даже в минимальных количествах сильное падение активности катализатора. Отсутствие сернистых соединений особенно валшо при Г. веществ ароматического ряда. Поэтому водород, применяемый при операциях Г., предварительно подвергают самой тщательной очистке. Темп-ру Г., в зависимости от гидрируемого вещества, необходимо держать в определенных, иногда очень узких, пределах. При низких тедш-рах скорость Г. мала, при высоких-она достаточно велика, но с повышением t° иногда происходит обращение процесса - наступает дегидрирование, т. е. водород отщепляется, и образуется снова ненасыщенное соединение. Если гидрируемое вещество способно присоединять несколько пар водородных атомов, то подбором соответствующей t° мож;но достигнуть различных последовательных ступеней Г. Так, при Г. антрацена при 180° получается пергидроантрацен и додекагидроантрацен, при 200°-октогидроантрацен, при 260°- тетрагидроантрацен. Область применения метода Сабатье весьма велика. Особенно легко гидрируются вещества, содержащие этиленовые двойные связи. Алифатическ. альдегиды и кетоны при 160° превращаются в алкоголи; при несколько высшей температуре получаются углеводороды. При каталитическом восстановлении ацетальдегида в этиловый спирт в технике берут большой избыток водорода (приблизительно в 30 раз больше, чем требует теория) для более равномерного распределения теплоты реакции. Примеси уксусной к-ты понижают активность катализатора; небольшие примеси кислорода, наоборот, выгодны, т.к. при полном отсутствии кислорода образуется около 15% этилового эфира. Ароматич. альдегиды и кетоны превращаются в углеводороды; напр., из ацетофенона образуется этилбензол, из бензола-дифенилэтан. Из алифатич. азотистых соединений (нитросоединений, алкилнитритов, оксимов, азинов, анилов, нитрилов) при 180-220° получаются первичные, вторичные и третичные амины. Восстановление в присутствии никеля ароматич. нитросоединений не дает удовлетворительных результатов. Поэтому в таких слаях пользуются медным катализатором, к-рый получают восстановлением в токе водорода гидрата окиси меди при 180-200°. Для этой же цели были предложены также золото и серебро (Г. П. 263396), закись и закись-окись железа (Г. П, 273322). Одним из наиболее важных применений метода Сабатье является гидрирование ароматических соединений. Бензол при 180-190° коли-Фиг. 2. чественно переходит в цик-логексан, толуол-в метил-циклогексан. Гомологи бензола при повышенных температурах гидрируются с отщеплением наибо.1ее длинных боковых цепей; фенол при 180-190° превращается в смесь цик- логексанола и циклогексанона, наряду с небольшими количествами циклогексаиа. При повторном пропускании этой смеси вместе с водородом над никелем при 140-150° по-лА,п1ают чистый циклогексанол, находящк!! широкое применение в технике. Ароматич. амины, наряду с нормальными продуктами Г., частично отщепляют аммиак и превращаются во вторичные амины. Гетероциклические соединения при Г. легко разлагаются, а потому рекомендуется приготовлять их гидропродукты иными способами. 2) Г. в состоянии раствора. Метод Сабатье непригоден, если тело, подлежащее гидрированию, при переходе в парообразное состояние разлагается. Этот недостаток устраняется методами проведения процесса в состоянии раствора. Впервые гн-дрлрование в жидкой фазе применено Норманом при гидрогенизации ненасыщенных лсирных кислот и жиров на гидрогенизаци-онном заводе Herforder Ма-schinenfett- und Olfabrik   Фиг. 3. (Г. П. 149029). В 1906 г. Ипатьевьпя был naii-ден новый способ Г.-при повышенных давлениях. Около этого же времени Пааль и Скита разработали методику Г. посредством коллоидального палладия или платины. Первое Г. жидких органических веществ при помощи платиновой (или палладиевой) черни было осуществлено Фокиным и впоследствии детально разработано Вильштеттером. Способы Г. в состоянии раствора имеют ряд преимуществ перед способом Сабатье, так kj,k, кроме возможности точного учета расходуемого водорода, они позволяют вести Г. при низких темп-рах; этим устраняются вредные побочные явления в виде перегруппировок, отщепления воды и разложения образующихся продуктов. Одним из существенных условий Г. в жидкой фазе является возможно полное перемешивание гидрируемого вещества, катализатора и водорода. В лабораториях для этой цели применяют сосуды специальной формы (фиг. 2 и 3), которые или помещают на болтушку или встряхивают при помощи особых приспособлений. Для гидрирования при нагревании применяют сосуды, в нижней части которых вставлена электрическая лампочка, служащая источником тепла (фиг. 4). В технике тесное соприкосновение реагирующих веществ с катализатором достигается применением эмульсий или просто энергичным перемешиванием; в качестве катализатора применяется почти исключительно никель (его окиси и соли). Гидрирование приходится вести при несколько повышенных температурах (100-170°) и давлениях (3-15 atm).
|