
 |
|
|
Литература --> Производство газовых тканей был решен уже в первом Г. э. Вольта. Цинк и по настоящее время, за исключением, очень редких случаев, является незаменимым материалом в качестве анода. Вся история гальбанических элементов связана с отысканием наиболее подходящего материала в качестве катода вообще, кислородного электрода в частности и отчасти состава и обработки электролита. КлассификацияГ. э. может быть произведена по разным признакам. Конструктивное деление на элементы с одной и элементы с двумя жидкостями в настоящее время устарело. Существенное значение, подтверждаемое историей элементного дела, имеет химич. состав и исходное физич. состояние катодного материала (табл. 8). Изображения типичных представителей разных групп гальванических элементов даны в табл. I, где указаны и основные химические процессы и соответствующие последним электродвижущие силы. а) Г. э. с жидким катодным материалом (деполяризатором). Г. э. группы а -в большинстве случаев элементы с двумя жидкостями, с проницаемой перегородкой или без нее, имеют гл, обр. историч. интерес и академич. значение (классическая гальванич. цепь Даниеля). Находят более заметное применение в телеграфной практике элементы Мейдингера без диафрагмы. Более поздние Г. э. этой группы-элементы Шустера [*] с диафрагмой: I. Zn амальг. II. Zn амальг. КОН КОН NajCr,0, HjSO, HMnO. H,SO. С, эдс->2,75 V С, ЭДС-<2,85 V И Л, Даримонта [ ] с полупроницаемой перепонкой в порах перегородки. Табл. 8.-к л а с с и ф и к а ц и я гальванических элементов по химическол1у составу и исходному физическому состоянию катодного материала.
б) г, э. с твердым катодным материалом. Г. э. группы б имеют в настоящее время наибольшее практич. значе- Табл. I.-Типичные представители гальванических элементов. Группа А, а Г. э. Мейдингера  Zn + CuSOi = ZnSOi -f- Си эдс 1,1 V Группа А, б Г. э. с хлористым серебром  Zn + 2 AgCl = ZnClj + 2 Ag эдс 1,1 V Группа A, в He имеется Группа Б, а Г. э. с хром, жидкостью (Грене) Группа Б, б Г. э. типа Лекланше 3 2п + 2 СгО, + б H,SO = Crj(SOi)s + + 3 ZnSO. + 6 Н,0 эдс 2,0 V  Zn + 2 NH4GI + 2 MnOj = ZnClj + MnjO, + 2NH, + Н,0 эдс - 1,5 V Группа Б, в Г. э. типа Фери  Zn + H,0 + о = Zn(0H)2 эдс - 1,25 V ние. По разряду А к ним относятся, помимо указанного в табл. I элемента с хлористым серебром, применяющегося для медицинских целей, известные как эталоны 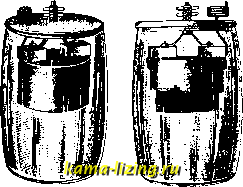 Фиг. 6. напряжения нормальные элементы-Кларка: Zn + U<z.,SO, = ZnSO. + 2 Hg, эдс 1,433 V при 15% и Вестона: Cd + HgSO = CdSO + + 2 Нд, эдс 1,0184 V при 20: но разряду Б к этой группе Г. э. относятся, помимо многочисленных форм выполнения известных Элементов Лекланще с нейтральным электролитом, несколько типов элементов со
Фиг. 7. щелочным электролитом (Лаланда, Эдисона, Ведекинда и других), работающих по следующей схеме: Zn 1 NaOH 1 CuO Си, эдс 0,8-1,0V; химическая реакция: Zn -Ь 2 NaOH + CuO = Zn(ONa)i + HjO + Cu. (25°Вё.) Одна из подобн. современ. американ. конструкций ]}\ представлена на фиг. 6 (левый 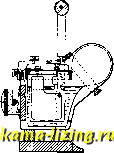 уголь Фиг. 8. щинк. пласт. Фиг. 9. рисунок-Г. э., не бывший в употреблении, правый-разряженный); разрядный график показан на фиг. 7. Эти элементы применяют- ся для железнодорожной и другой сигнализации и изготовляются размерами на 100- 600 Ah емкости. Вследствие их низкого напряжения эксплоатация обходится дорого; элементы эти чувствительны к колебаниям t°. Известны также элементы этой группы с кислотным электролитом, работающие по схеме: Zn I HjSO I PbO эдс - 2,40V; химическая реакция: Zn + 2 HjSO, -I- PbO, = ZnSO, + PbSO. + 2 HjO. Форма выполнения элемента этого типа для карман, фонаря изображена на фиг. 8 []. в) Г. э. с газообразным катодным материалом. Г. э. группы в в последние годы начинают приобретать промышленное значение (до сих пор, главным обр., во Фран- 0.25 -NHiCl -1п(0Н)г -InCh NHtOH ции); известны как элементы с воздушной деполяризацией, вернее - деполяризацией кислородом воздуха. Одним из первых получил более широкое признание элемент Фери. Своей работой с газовым электродом Фери не только дал пути к разрешению вопроса о значительной экономии расхода цинка в Г. э., но и удачно обошел затруднения, связанные с переходом кислорода из газа в ионное состояние, попутно осветив опытным путем механизм деполяризации [-12 ij i4j Сущность устройства (фиг. 9) этого элемента такова: на дне сосуда расположена горизонтально цинковая пластинка; в непосредственной с ней близости находится вертикальный угольный электрод, Фиг. 10. Фиг. 11. 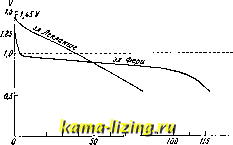 сутки Фиг. 12. особым образом изготовленный, с высокой пористостью и электропроводностью, выступающий над электролитом (раствором хлористого аммония). Физико-химические процессы элемента Фери. Теоретическое ур-ие Zn -f 11,0 -Ь Оеозй. = Zn(OH), не совсем точно. Фактически процесс распадается на две фазы. В первой фазе: Zn -1- 2 NH4CI -f Н,0 -Ю = ZnCl, + 2 NH OH образуется ZnCl2, как и в обычном элементе Лекланше, но затем, по мере работы, происходит расслоение электролита на три слоя: Табл. 9.-Сравнение элементов Фери, Лекланше и Мейдингера по расходу главных материалов (на 1 Ah).
удельно тяжелый ZnClg (слабо кислая среда) остается на дне и покрывает цинк (фиг. 10)[ ], предохраняя его от неравномерного разъедания; образующийся на угле уде.тгьно более легкий раствор NHOH всплывает наверх (слабо щелочная среда), а посредине остается по преимуществу нейтральный раствор неизрасходованного NH4CL По мере сближения крайних слоев и уменьшения общего содержания NH4CI в растворе наступает вторая фаза процесса: ZnCU + 2 NH4OH = Zn (0Н)2 + 2 NHiCl, при чем NH4CI частично регенерируется, а осадок окиси цинка выпадает на границе соединения крайних слоев; нижняя, обращенная к цинку, часть угольного электрода все время остается чистой и, главное, погруженной в раствор ZnCla. Противоположно направленная эдс жидкостной пары (фиг. 11) L] + ,ZnCbNH40H,-, приблизительно равная 0,25 V, не уменьшает основной эдс, т. к. замкнута накоротко угольным электродом. Угольный (газовый) электрод в нижней части насыщается адсорбированным водородом, в верхней-кислородом. Степень деполяризации этого электрода обусловливается работой коротко замкнутой пары: -С I H.,ZnClj I NHiOH,0 [ С + с эдс -0,5-1.0 V. Этим объясняется устойчивость работы элемента, к-рая зависит гл. обр. от качества угольного электрода. Сравнение Г. э. с газовым, твердым и жидким катодным материалом. Сравнительный график разрядок элемента Фери с элементом Лекланше 10 0,75 0.S W 20 30 40 SO 60 70 дО SO /00 ПО 120 Ш М Фиг. 13. показан на фиг. 12 [j. Сравнительный расход материалов в элементах с различным физическим состоянием катодного материала показан в табл. 9 [j для случая разрядки очень слабым током или более сильным с перерывами. Фери дает следующие сравнительные стоимости выработки одного Ah:
Другой метод сравнительной оценки Г. э см. ниже. Кроме элементов Фери, в настоящее время известны элементы с воздушной деполяризацией Le Carbon е [*] и со щелочным электролитом Нея [Ij, Нюберга [ ] и Юнгнера На фиг. 13 дан разрядный график Г. э. фирмыLe Carbone, тип AD 220, на постоянное сопротивление 5. Г. э. мокрые и сухие различают по состоянию их электролита: в виде жидкого водного раствора, или превращенного в желеобразную, клейкую массу каким-либо загустителем (крахмал), или, наконец, в виде малоподвижного и невыливающегося, для чего жидким электролитом пропитывают пористую инертную массу-наполнитель, (древесные опилки, гипс, песок, картон). Сухие Г. э. типа Лекланше. Г. э. типа Лекланше с сухим электролитом издавна получили наибольшее практич. применение и промышленное значение. В связи с этим в последнее время проделано много работ для освещения происходящих в нем физико-химических процессов. Схема гальванической цепи этого элемента: -Zn I ZnClj, NHiCl, Aq ЙпОг С + УстановленоP]раскисление MnOj до МП2О3. В отличие от элемента Фери (вертикальное расположение электродов и присутствие в электролите ZnClg), расслоенное малоподвижного электролита здесь наступает в меньшей степени. Различают три стадии химических реакций: I. Zn + 2NH4Cl + 2MnO,= ZnCU+Mn,0,+2NH, + H,0 (начальная при насыщенном NHCl электролите). II. Zn + 2NH C1 + 2MnO, - ZnCla 2NH, + Mn,0,+ HO кристаллич. осадок (связывание NH, при уменьшении NH4CI). III. Zn + HjO + 2MnO, Zn(OH), + МПаО, аморфный осадок (связывание НзО при большой концентрации ZnClj и малой NH4CI). Кроме того, взаимодействие NH4OH и ZnCIg при нек-рых условиях [з] сопровождается
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||