
 |
|
|
Литература --> Производство газовых тканей тивлеция электролита; иногда гт. е. г является функцией времени разрядки t или времени хранения г; эдс поляризации Ef) = f{l, t) иногда объединяется с г под общим названием-внутренние потери, иногда Ер выражается в % от Е. Ур-ия, связывающие эти величины, следующие; V=E-E~IrIR, {Е - Ер) - V Г =-J---Полагая эдс поляризации пропорциональной силе тока, т. q.E - kl, что близко к действительности, и принимая /с -Ь с, получим выражение внешней вой эффект химической реакции с электродвижущей силой Г. э. Ур-ие Гельмгольца: Q , rj.dE 0,239nF dT характеристики Г. э.: где с= cF, и силы тока: Д +с при последовательн. соединении п элементов в батарею: где Е-эдс Г. э. в V; Q-тепловой эффект в cal; п-число валентностей ионов, вступающих в химическ. реакцию, тепловой эффект к-рой Q; F-фарадей = 96 540 С = 26,8 Ah; 0,239-коэфф-т перевода J в cal; Т-абсо- лютная темп-ра химич. процесса; --температурный коэфф. эдс; для Г. э. он обычно меньше ImV на 1° (см. табл. 1). Табл. 1.-Т емпературные коэффициенты эдс гальванического элемепта[М-
R + nc при параллельном соединении n элементов: В батареях в применяется. иная группировка. элементов настоящее время почти не Электродвижущая сила: Е=т + 1с; мощность отдача полезн. максимальная мощность при В = с Графически внешние характеристики для Г. э., у к-рого = IV и с = 1ft, изображены на фиг. 4; очевидно, что Г. э. по существу дела предназначены для работы при весьма малой разряди, мощности, т. к. максимальная полезн. мощность составляет лишь 25 % возможной при данной силе тока и напряжении цепи=эдс источника. Емкость по току; при / = Const, Aj = Ito; npHjR-Const, Ar= = J Vdt, где 0 -разрядный период в часах. Емкость по энергии: при 1 = Const, Wi = I.r,p ta = l] Vdt\ при R - Const, Wr = - Vdt. Термодинамические теории. Химические процессы, имеющие место в Г. э., с точки зрения термодинамики рассматривают как изотермически обратимые и, прилагая к ним уравнение свободной энергии, получают выражение, связывающее тепло- Для данного Г. э. температурный коэфф. эдс может менять свою величину и знак в зависимости от концентрации реагирующих веществ и Т°. Приводимая табл. 2, дающая 268 Фг. 4. значения эдс Г. э. при различных t°, позволяет вычислить также и соответственные значения температурного коэффициента эдс и убедиться в его изменчивости. Табл. 2.-Э дс гальванического элемента при низких t р].
Г. э., обладающие наименьшим температурным коэфф-том, при соблюдении ряда других условий применяются как эталоны эдс. При значении близком или равном нулю, для вычисления эдс Г. э. применима более простая формула (правило Томсоиа): 0,239nF Пользование ввтшеприведенными формулами требует экспериментального определения и точного учета суммарного теплового эффекта химических реакций Г. э., что затруднительно и не всегда возможно. Это затруднение устраняется помощью 3-го начала термодинамики, дающего возможность исчислять эдс Г. э. из одних термических данных р]. Осмотическая теория Г. э. Потенциал £ соприкосновения пары электрод-электролит на основании осмо-тич. теории Г. э. Нерн-ста выражается следующей формулой: RT , р £ = -= In -> nF р где и Г имеют указанные выше значения; л - - электролитическая газовая константа, численное значение которой 0,864x10-4, если е выражено bV;P-упругость растворения электродного материала ;р=:: = кС есть давление ионов в растворе, где С- концентрация ионов, выраженная в грамм-ионах/л. Ф-ла Нернста позволяет изучать в отдельности явления на аноде и катоде. Более удобно для пользования ее выражение в зависимости от концентрации ионов в электролите; , 0,058 , водородный £д или каломельный в, связанные уравнением: £ц e-f 0,286 вольт (при 18°). Абсолютный потенциал (не общепризнанная величина [®]) испытуемого электрода через вспомогательный определяется из ур-ий: €абс. = + 0.274; £абс. = + 0>560: или графически-см. фиг. 5 и табл. 3 [*]. На фиг. 5 С указывает на потенциал относительно каломельн. электрода, Н-относительно 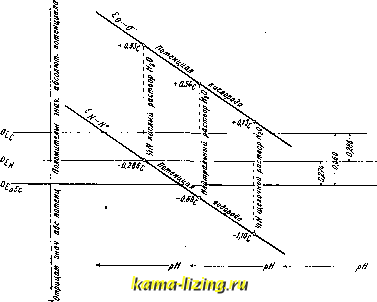 Фиг. 5. водородного электрода, рН-концентрация ионов водорода, N-нормальный раствор. Табл. 3.-Н ормальные потенциалы кислорода (в V). водорода и где £ -постоянная, характерная для каждого иона величина, называемая электролитическим потенциалом соотв. электрода относительно электролита, содержащего 1 испытуемый грамм-ион в л (£ дается для 18° со знаком, отвечающим электроду в справочных таблицах нормальных потенциалов) [5], Ig С-поправочный член на изменение концентрации,-берется со знаком (+) в случае образования катионов M-M * и со знаком (-) в случае образования анионов Х- Х- [*]. Эдс гальванич. цепи получается как разность потенциалов отдельных электродов: Е -= [± £(+)] - [ ±£(-)] вольт. При непосредственном измерении £ в качестве условного нуля применяются вспомогательные электроды, обычно нормальные:
Явления в замкнутой цепи (поляризация Г, э.). При прохбзкдении тока потенциалы электродов, а с ними и эдс, изменяют свои первоначальные значения в разомкнутой цепи в зависимости от плотности тока на электродах и времени разрядки Г. э., благодаря изменению сопротивления электролита и отчасти электродов и в связи с изменением во времени состава и концентрации действующих веществ. Совокупное действие этих причин, выражающееся в нарастании внутренних потерь Г. э. по мере его разрядки, носит название поляризации Г. э. Характером и степенью поляризации (в этом общем смысле) обусловлены наиболее важные технические свойства Г. э. Различают следующие виды гальванической поляризации (табл. 4): Табл. 4 .-В иды поляризации гальванических элементов.
Деполяризация. В применении к Г. э. под деполяризацией обычно подразумевают лишь катодную деполяризацию в виду того, что против анодной, по незначительности ее, мер не принимается. Отсюда под названием деполяризатор понимают не добавочный материал, а основное действующее на катоде вещество, что, разумеется, не совсем правильно. В силу технических и экономич. причин наибольшее практич. значение приобрели Г. э., в к-рых в качестве анода применен сплошной металлический, hr. н. растворимый, электрод, а в качестве катода-пористый, нерастворимый, большей .частью кислородный электрод, j Явления в разомкнутой цепи ({саморазряд Г. э.). Побочные процессы в ,Г. э. связаны с второстепенными реакциями, имеющими место при разомкцутой внешней ;цепи. Они имеют большое значение для хра-1нения Г. э., вызывая так называемый са--моразряд элементов. Внутренние причины (исключая, разумеется, короткие замыка-*ния, небрежное изготовление и прочее), саморазряда сгруппированы в табл. 5. Степень действия металлических пар (группа А, а) обусловлена не столько эдс цепи Ml I электролит Mj, раств. электрод постор. металл СКОЛЬКО ЭДС следующей цепи: Mj I электролит Н2(М.2), к-рая определяется величиной добавочного напряжения (перенапряжения), необходимого для выделения водорода на поверхности данного материала. Величины этих добавоч. напряжений для наиболее важных материалов при гладкой поверхностиданывтабл.6[П. Т а б л. 6.-Пе р е н а п р я ж е н и я водорода на гладкой металлической поверхности.
Этим, например, объясняется безвредность присутствия свинца в цинке Г. э. II. Основные виды Г. э. История развития Г. э. видна из табл. 7. Табл. 7.-И сторические даты развития элементов.
Эта сводка показывает, что в отношении анода вопрос технически удовлетворительно Табл. 5.-Классификация побочных явлений в гальванических элементах. Группа явлений Причина Действие Внешнее проявление г р у п п а А Действие на металлический растворимый электрод Группа Б Взаимодействие электродов а) Местная пара создается присутствием в исходном материале электродов или электролита посторонних примесей (металлов или их соединений);,б) концентрационная цепь создается неодинаковой плотностью электролита или неодинаковой физической структурой металла в разных точках поверхности; в) химич. растворение электрода, например действием растворенного в электролите . кислорода г) Присутствие в электролите примесей в виде ионов разной эалентности, наприм. Fe Fe д) Диффузия растворенного катодного материала к аноду или обратно Неравномерный износ, потеря емкости одного электрода,пре-ждев ременный выход из строя всего элемента Потеря емкости обоих электродов!(незначительная) Незначительн. уменьшение эдс, заметное увеличение внутренних потерь Возможно значительное уменьшение эдс и значительное увеличение внутренних потерь
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||