
 |
|
|
Литература --> Графическое определение перемещений д.-результат теплового молекулярного двилсения, и потому наличие процессов Д. является одним из доказательств молекулярного строения вещества. Здесь рассматривается Д. только свободная. О Д. через перегородки см. Диализ и Осмотическое давление. Математическая теория Д., сводящаяся, главным образом, к исследованию интегра-.та 2-го закона Фика при различных предельных условиях, была развита в особенности Стефаном (1879 г.). Д. газов и наров исследовалась двумя экспериментальными методами. Первый метод, кинетический, использованный в особенности Лошмитом и Обермайером, состоит в измерении парциального давления или концентрации одного из компонентов в одном определенном слое диффузионного сосуда (диффузиометра) с течением времени. Второй, стационарный, метод (Стефана) состоит в том, что в концах сосуда концентрации искусственно поддерживаются все время постоянными: в нилс-ней части поддерживается максимальная концентрация тяжелого компонента, например, соответствующая этому компоненту в чистом виде (Д., как всегда, производят против действия силы тялгести), а в верхней части с этого компонента поддерживается равной нулю. Тогда устанавливается стационарное, т. е. независящее от времени, состояние Д., при чем исследуется распределение с с высотой X (измеряется постоянНЫЙ градиент -1 . Стационарный метод усовершенствован Винкельманом и применен им к Д. паров. При этом пользуются, напр., прибором, изображенным на фиг. 1. Жидкость, находящаяся в капиллярной трубочке, поддерживает у своей поверхности давление насыщенного пара. Во внешней же трубке все время циркулирует какой-либо газ при атмосферном давлении, так что у конца капилляра парциальное давление пара жидкости равно О, и жидкость испаряется только благодаря стационарной диффузии. Измеряя катетометром (см.) понил:.о-ние уровня жидкости в капилляре, находят коэффициент диффузии пара в данный газ. Ниже в таблице приводятся некоторые значения D в см-1ек. Значения н о э ф ф и ц и е н т а д и ф ф у и и. 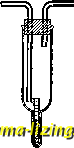 Фиг. 1 . Диффундирующий пар Диффузия н CjHsOH (эти.довып спирт) CjH, (бензол)
Молекулярно-кинетич. теория Д. в газах была разработана Клаузиусом, Максвеллом и другими и особенно Ланжевеном; простейшая теория дает для D выражение: где Я-средняя длина свободного пути, v- средняя скорость молекулярного (теплового) двилгения. Это выражение пригодно только  Кривые распределения с с высотой х для разных моментов времени т (в общем случае) представлены на фиг. 2. для малых с одного из компонентов или для Д. газа в самого себя , и из него видно, что D должен быстро возрастать с Г, про- порционально ; как видно из таблицы. D действительно возрастает с темп-рой, при чем D=kT\ где п изменяется от 1,7 до 2,0. Для связи D с внутренним трением v газа молекулярно-кинетическ.теория дает: -D=j , где Q-плотность газа. При изменении парциального давления (или с) диффундирующего вещества D почти не изменяется. Д. в жидкостях подчиняется тем же законам и исследуется теми же методами, что и в газах. Так, Грем, Ёгольм и другие, а в особенности Сведберг, применяли кинетич. метод, выбирая из диффузиометра при помопщ сифонной трубки последовательно 3-4 слоя одинакового объема и анализируя их на содержание диффундирующего растворенного вещества. На фигуре 3 представлен один из самых удобных диффузиометров - прибор Сведберга. Заполнение пробной пипетки производится давлением воздуха, вдуваемого резиновой грушей или посредством газометра. Простейший метод измерения коэффициента D, без взятия проб, состоит в измерении коэффициента преломления для разных X или, при стационарном методе, в измерении отклонения луча, проходящего через кюветку, где происходит Д., напр. в измерении смещения метки, видимой в микроскоп через кюветку (микроскопич. метод Фюрта). Для осуществления стационарности можно на дно сосуда помешать слой чистого диффундирующего вещества. Заполненный водой сосуд помещают в большую банку с проточ- 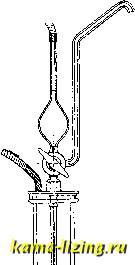 Фиг. 3. ной водой постоянной t° (Фик). При этом все время с внизу сосуда будет наибольшей, а наверху с=0; так как = О, то = Const, т. е. с будет линейно изменяться с х. Законы Д. электролитов изучены Нерн-стом, показавшим, что для случая полной диссоциации (в слабых растворах) где и, V-подвижности катиона и аниона; иф V, и потому ионы разного знака диффундируют с разной скоростью, что создает всюду, где есть градиент концентрации, электрич, разность нотенциалов-д иффузион-ный потенциал, существуюшую пока вследствие Д. концентрации не выравняют-ся. Д. электролитов разными методами исследовал В. С. Титов, показавший, между прочим, применимость закона Фика и к смесям электролитов, если концентрации их рассчитывать в грамм-эквивалентах. D в жидкостях, как и в газах, значительно возрастает с Г и очень мало изменяется с с. Д. является чрезвычайно важным молекулярным свойством для сулодения о величине растворенных частиц, т. е. о коллоидно-сти или кристаллоидности растворенного вещества (его степени дисперсности). Кристаллоиды, находясь в растворе в виде отдельных молекул или ионов, диффундируют быстро, .Д. же коллоидов (см.) из-за большой величины их частиц-молекулярных сгустков (мицелл) сильно замедлена (в 100 и более раз) сравнительно с кристаллоидами. Рассматривая растворенные (наприм., коллоидные) частицы как шарики радиуса движущиеся в вязкой среде, и пользуясь для силы сопротивления среды движению каждого шарика выражением Стокса F = =влгг]у {п-вязкость среды, v-установившаяся скорость движения, обусловленного наличием градиента осмотического давления ВТ , Эйнштейн и Смолуховский пришли к выран№нию: В обратно пропорционален г и п (закон Сведберга), и его измерение молсет слулсить для определения ра.змеров частиц. В связан далее простым соотношением со средним квадратичн. перемещением х коллоидных частиц при броуновском движении (см.): ж2 = 2 D т , где т-время, для к-рого вычислено х. В гелях, т. е. в застывших, полутвердых коллоидных растворах (напр., в желатине), Д. протекает практически с той же скоростью, что и в чистом растворителе. Этим пользуются для устранения вредного влияния конвекционных токов при диффузионных измерениях. Все обычные изл1ерения Д. затруднительны из-за необходимости тщательно охранять прибор от сотрясений и от колебаний t° и потому производятся обычно в подвальных помещениях. Лит.: Тимирязев А. К., Кинетич. теория материи, М.-П., 1923 (молен. К1гаетич. теория Д. в газах); Т 11 о w W. S., Ztsch.r. f. phys. Cliemie . Lpz., 1913, B. 84, p. 15; JeUinek K., Lehrb. (1. phys. Chemie. B. 2, p. 609-840, Stg., 1927 (общин обзор); Arndt К., Handbuch d. phys.-chem. Tech- nik, 2 Auflage, p. 602, Stg., 1923 (методика измерений); Stefan J., Wiener-Berichte , Wien, 1879, B. 2. p. 79, 161 (математическая теория); Cohen E. und Bruins H. R.. <.Ztschr. f. phys. Chemie , Leipzig. 1922, B. 103, p. 349, 1924, B. 113, p. 157 (обзор новых методов); S w e d Ь e г g Т., Existenz d. Molekule, Leipzig, 1912. П. Ребиндер. ДИХРОИЗМ, изменение окраски (в проходящем свете) в анизотропных окрашенных те;шх в зависимости от направления световых лучей. Дихроизм обнаруживают многие кристаллы: турмалин, берилл, дымчатый топаз, пеннии и другие окрашенные тела, испытывающие временную или случайную анизотропию (закаленные окрашенные стекла, текущие жидкости). Д. неразрывно связан с двойным лучепрстомлением; индекс поглощения, так же как и показатель преломления, зависит от направления луча в кристалле. Д. обнаруживают оптич. одноосные системы; в оптически двухосных окрашенных кристаллах имеются три взаимно перпендикулярные направления, по которым окраска существенно различна; в этом случае говорят о трихроизме. Совокупность Д. и трихроизма называют плеохроизмом. Для качественного обнару-лсеиия Д. могут служить дихроскоп Гай-дингера, состоящий из кристалла исландского шпата, помещенного между маленькой квадратной диафрагмой и лупой. Если перед диафрагмой поместить тело, обладающее Д., то два рядом стоящие изображения диафрагмы в поле зрения будут окрашены раз-личным образом. Кспичественное определение дихроизма может быть произведено спектрофотометрически. Дихроизмом удобно пользоваться д-ля изучения двойного пре-лом-пения в окрашен, средах. Дихроизм не следует смешивать с дихроматизмом (см.), совершенно не зависящим от анизотропии и определяемьпу! чисто физиологическими особенностями зрения. Лит.: Becker А.. Kristalloptik, Stuttgart, 1903; W е i g е г t F., Optische Methoden d. Chemie, Leipzig, 1927; Drude P., Lehrbuch der Optic, Leipzig, 1912. C. Вавилов. ДИХРОМАТИЗМ, резкое изменение окраски (в проходящем свете) некоторых растворов и стекол при изменении концентрации; например, слабые растворы цианина имеют синюю окраску, сильные-красную; если посмотреть на освещенную солнцем траву через синее кобальтовое стекло, то трава будет казаться синей, если же прилолсить к кобальтовому стеклу еще желтое, то трава покажется красной ; нек-рые зеленые стекла, сложенные вместе, пропускают только красный цвет. Причина Д.--в наличии в соответствующих средах двух спектральных областей со слабым поглощением, разделенных сильной полосой абсорбции. Пусть в одной из таких областей, наприм., зеленой, поглощение несколько больше, чем в другой-красной, но в то же время яркость падающего света в зеленой части больше, чем в красной; тогда при слабой концентрации или же небольшой толщине стекла предмет будет казаться зеленым. Наоборот, при увеличении концентрации зеленый свет практически целиком поглотится, но красный-будет проходить. Дихроматизм может быть использован для разного рода световых эффектов. с. Вавилов ДИЭЛЕКТРИКИ, вещества, в к-рых может существовать электрич. поле. Электрич. заряды, находящиеся в Д., смещаются под действием поля, ослабляя его. Если в Д. имеются заряды, способные свободно перемещаться, то их движение будет продолжаться до тех пор, пока поле внутри Д. не будет компенсировано полем, создаваемым этими зарядами. Чем выше электропроводность вещества, тем быстрее исчезает в нем электрич. поле. Поэтому электрич. свойства таких тел, как металлы или хорошие электролиты, м.б. обнаружены только при очень кратковременных или частопеременных процессах. Типичными же Д., к к-рым обычно и относится это название, являются вещества, обладающие весьма большим удельным сопротивлением в 10й и выше до 102°й. Количественной характеристикой Д. является диэлектрическая постоянная (диэлектри-ческ.) кофф. £-отношение между электростатич. индукцией D и напряжением поля Е: D=eE. (1) Если внутри Д. перпендикулярно к силовым линиям представить себе узкую щель площадью в 1 см, то на обеих сторонах щели, благодаря смещению положительных зарядов в одну сторону, а отрицательных-в противоположную, появится электрич. заряд Р, к-рый называется диэлектрич. поляризацией. Число линий индукции, создаваемой этой поляризацией, будет АлР, к-рые вместе с линиями основного поля Е создадут индукцию D: В = Е + 4лР. (2) Поляризация Р может считаться пропорциональной электрич. полю Е: Р=кЕ. (3) Коэфф. к называется коэфф-том электризации. Существенную роль в учении о Д. играет также сила F, действующая внутри Д. на любую из его молекул. Чтобы подсчитать эту силу, нужно было бы выделить вокруг молекулы небольшое шаровое пространство. На молекулу, кроме внешнего поля Е, будут действовать также поля окружающих молекул, вызывая поляризацию среды: F-E + aP. (4) В случае молекул, обладающих достаточной симметрией a=7i. Так как поляризация молекул вызвана действующей на них силой F, то можно считать P=PF, (5) где /9 будет пронорционально числу поляризованных молекул N. Если обозначить плотность вещества через q , а его молекулярный вес через М, то для единицы объема N = и, следовательно, поляризация Р единицы объема равна Здесь у выражает поляризуемость отдельных молекул. Приведенные формулы дают следующие соотношения: £=l-f47r7c, (7) е-1 м 4:Г,. Ф-ла (8) представляет собою выражение закона Клаузиуса-Моссоти. Стоящая в левой части величина, которая может быть названа молекулярной поляризацией, характеризует собой химические свойства данного вещества. Она не зависит от его плотности и аггрегатного состояния. Поляризация Д. может иметь двоякое происхождение: во-первых, раздвилгение противоположных зарядов внутри каждого атома и каждой молекулы и, во-вторых, поворот по направлению электрич. поля молекул, если они по своей химич. структуре обладают уже электрич. диполем. В первом случае диэлектрич. постоянная почти не зависит от Г и мало зависит от частоты переменного поля вплоть до тех высоких частот (порядка 102 пер/ск. и выше), где уже начинает сказываться резонанс с собственными колебаниями молекул. В этом случае диэлектрич. постоянная е близка к квадрату показателя преломления п для длинных волн: е и не превышает 3-4. Во втором случае поворот диполей по направлению поля противодействует тепловому движению, стремящемуся разбросать их по всевозможным направлениям. Чем ниже температура, тем слабее это противодействие и тем выше диэлектрическая постоянная. Дебай, которому принадлежит теория ди-польной поляризации и ее опытное изучение, дал для молекулярной поляризации следующее выражение: е-Ь2 Q Здесь первый член правой части выражает, как в (8), поляризацию, вызванную только смещением зарядов, а второй член-поляризацию вследствие поворота диполей; ,и представляет собою электрич. момент диполя, а Т-абсолютную темп-ру. Зависимость диэлектр. постоянной от частоты в случае поворота диполей определяется испытываемым им трением при повороте. С увеличением частоты наступает уменьшение диэлектрич. постоянной, и при больших частотах в выражении (9) остается только первый член. Точно так же при переходе в твердое состояние поворот диполей либо делается невозможным либо чрезвычайно затрудняется уже при небольших частотах. И в этом случае выражение (9) сводится к одному первому члену. Обычно второй член значительно больше первого, и поэтому Д. с вращающимися диполями обладают диэлектрич. постоянной порядка нескольких десятков (для воды, например, е 80). В очень сильных электрич. полях диэлектрическ. постоянная дипольных жидкостей падает, т.к. наступает насыщение. Очевидно, напр., что дальнейшее нарастание поля не может увеличить поляризацию, когда все диполи повернутся вдоль поля. Наконец, присутствие диполей в молекулах проявляется в величине сил молекулярных взаимодействий, которые ведут к образованию сложных ассоциированных молекул [в случае воды, нанр., (НаО)б, (HgO)!,..]. Дипольные моменты fi имеют следующие значения для нек-рых жидкостей и газов в электростатич. единицах: вода 1,87-10~1; хлористый водород 2,15-10~ , ни-
|