
 |
|
|
Литература --> Графическое определение перемещений Вальдену, путем исследования значительного числа растворителей, удалось подтвердить гипотезу Дж. Дж. Томсона и Нернста о зависимости Д. э. в растворе от диэлектрических свойств растворителя. Диэлектрическая постоянная определяет степень сопротивления, испытываемого образовавшимися ионами, для обратного соединения в нейтральную недис-социированную молекулу. Для одного и того же электролита Вальденом было установлено следуюш;ее взаимоотношение: Dfv = Dx fvj = D2 ГгГа = ... = Const, где V, Vl, fg...-различные разведения, а D, Dl, Dg...-диэ.чектрические постоянные разных растворителей. Необходимо подчеркнуть, что степень диссоциации возрастает значитсиьно быстрее, чем величина диэлектрической постоянной. Причину Д. э. разные исследователи толковали по-разному. Крюгер усматривал эту причину в действии поглошаемых растворами инфракрасных лучей. Коссель ( Аппа1еп d. Phys. , 1916, В. 49, р. 229), опираясь на современные представления о решетке кристаллического вещества, образованной положительно заряженными ионами, чередующимися с отрицательн., выводит (на основании закона Кулона) для КС1, что, при заряде одновалентн. иона в 4,65 10~ эл.-ст. ед. и при расстоянии между центрами двух ионов, равном 2г (где г = 2 10~сж), энергия взаимного притяжения двух ионов равна: D = 4,65 10-20+8= 5,4 10-1 эргов. При этом Х> = 1, ибо предполагается, что КС1 находится в газообразном состоянии. При растворении КС1 в воде, диэлектрическая постоянная к-рой равна 80, энергия становится равной 6,8-10- эргов, а эта величина будет того же порядка, что и кинетич. энергия воды при комнатной температуре. Поэтому, при ударах молекул растворителя о подвергающийся растворению электролит, из последнего могут образоваться ионы. Как уже было указано, вся стройная система теории Д. э. хорошо подтверледает-ся при опытной проверке для электролитов слабой и средней силы, т. е. для тех, к-рые лишь при весьма сильных разведениях подвергаются полной Д. э. Для сильных электролитов (напр., NaCl) эта теория оправдывается на опыте лишь в отношении весьма разведенных растворов (0,00Ш). Для более концентрированных растворов сильных электролитов определение электропроводности, на первый взгляд, также заставляет предполагать, что молекулы электролита диссоциированы не полностью, ибо величины электропроводности оказываются меньше тех, к-рые можно вычислить в предположении, что диссоциация была бы полной. Осмотич. давление, определяемое экспериментально, также оказывается меньшим, чем можно было бы считать в предположении полной диссоциации. Однако, при попытке вычислить на основании результатов экспериментов, относящихся к обоим указанным явлениям Д.т1я сильных электролитов, какая доля общего числа молекул подверглась Д. э., обнаруживается, что оба метода- электропроводности и определения осмотич. давления - дают разные ответы на поставленный вопрос. Это обстоятельство главным образом и навело Бьеррума на предпололсе-ние, что сильные электролиты всегда, даже и в самых концентрированных растворах, нацело диссоциированы на ионы, что подтверждалось, между прочим, и произведенным еще ранее исследованием оптических и каталитических свойств сильных электролитов. Однако нри больших концентрациях разноименно заряженные ионы сильных электролитов уже не так свободны в своих движениях, как в разведенных растворах: они испытывают влияние электрического поля противоположно заряженных ионов, которые, т. о., несколько связывают свободу их движения. Это обстоятельство и находит отражение в изменении величин электропроводности растворов, а также и в изменении осмотическ. давления, однако не в одинаковой степени для обоих явлений. В связи с этим Бьерруму пришлось ввести новые понятия: фактор активности ионов, фактор электропроводности и фактор осмотич. давления. Ионная активность для концентрированных растворов сильных электролитов значительно меньше, чем ионная концентрация. Другими словами, только часть всех ионов си.чьного электролита, несмотря на полную его диссоциацию, находится в химически активном состоянии, остальные ионы связаны электростатич. силами притяжения противоположно заряженных ионов. Заслуга детального количественного изучения действующих в этих случаях м е ж-д у и о н н ы х сил принадлелгит Дебаю и Гюкелю (1923 г.). Опираясь на закон Фарадея-Кулона и приняв для ионов форму шара конечного диаметра, они вывели ф-лы, учитывающие междуионные силы д.пя осмотического давления, электроироводности и прочих констант, относящихся к сильным электролитам. Их вычисления очень удовлетворительно совпали с экспериментальными данными, добыгыми уисе после их работы Бронстедом и Ла-Мером. Т. о., в самое последнее время теория Д. э. получает значительное расширение и дополнение, главн. обр. со стороны физики, и область изучения растворов электролитов приобретает характер электрич. теории растворов. Лит.: Вальден П. И., Теории растворов в их истории, последовательности, П., 1921; И з г а р ы-HI е в Н. А., Современная теория растворов, М., 1924; Б ь е р р у м, Электрич. силы между ионами в растворах, Успехи физических наук , М.--Л., 1927, т. 7, вып. 3-4, 1927; Финкельштейн Б. Н., Электрич. теория растворов сильных электролитов, там же, вып. 5-6; Беркенгейм А. М., Основы теоретической химии, 2 изд., М.-Л., 1926; Леман Г., Измерение концентрации водородных ионов, М., 1929 (печатается); N е г п s t W., Theoret. Chemie vom Standpunkte d. Avogadroschen Regel u. d. Thermodynamik, Stg., 1925. Б. Берненгейи. ДИССУГАЗ, ацетилен под давлением, применяемый в ацетоновом растворе в виду того, что сжатый ацетилен отличается взрьш-чатостью. Приготовляют диссугаз следующим образом: стальной баллон, обычно употребляемый для сжатых газов, наполняют пористой массой (инфузорн. землей), пропитанной ацетоном; затем туда вводят очищенный и высушенный ацетилен под давлением 12-15 atm. При таком давлении 1 ч. ацетона может растворить до 300 ч, ацетилена (растворимость зависит от степени чистоты ацетилена). Присутствие пористой массы устраняет возможность взрыва при высоких давлениях (выше 10 aim). Д. применяется при автогенной сварке (см.) металлов, а также служит осветительным материалом для автомобильных прожекторов. Лит.: Jaeger Н. U. U 1 г i с li s, Die Azely-len-Verordnung, Halle a/S., 1923; Handbuch f. Aze-tylen, hrsg. V. J. H. Vogel, Lpz., 1904; Vogel J. li.. Das Azetylen, seine Eigenschaften, seine Herstellung und Verwendung, 2 Aufl., Lpz., 1923; Vogel J. H. und S с h u 1 z e A., Karbid u. Azetylen als Ausgangma-terial f. Produkte d. cliemisicheu Industrie, Lpz., 1924. ДИСТАНЦИОННАЯ ТРУБКА, приспособление для производства разрыва снаряда (шрапнель, бризантный снаряд) в воздухе в определенный момент полета. В хвосте Д. т. расположена ударная трубка, имею-шая назначение, в случае отказа дистанционной части, вызвать разрыв снаряда при попадании его в препятствие. Такие трубки,двойного действия, в настоящее время исключительно и употребляются. Устройство Д. т. представлено на фиг. 1. Основанием трубки служит алюминиевый стебе.пь, к-рый имеет головку 1, тарель 2 и хвост 3. В головке стебля расположена дистанционная часть, в хвосте-ударная. В дистанционном ударнике 4 закреплен сверху капсюль. Ударник в своей нижней части удерживается от преждевременного смещения разрезным кольцом 5. На тарель 2 накладываются два дистанционных кольца-неподвижное б и нижнее подвижное 7-и прижимаются латунной гайкой 8; в нижнюю часть каждого кольца впрессован дистанционный кольцевой состав 9. Концы обоих кольцевых составов разделены перемычкой. Один конец нилснего кольцевого состава входит в вертикальный канал а (фнг. 2), сообщающий его с верхним кольцевым составом; верхний же кольцевой состав окошком б сообщается с нижним кольцевым составом и обращен к окошку 10 (фиг. 1) головки стебля. Стенки каналов покрыты приклеенными на лаке пороховыми зернами. При установке нижнего дистанционного кольца на К (картечь) очко его а приходится под очком б верхнего кольца и над канальцем 11 тарели; при смещении снаряда и воспламенении ударника о жало пламя кратчайшим путем проникнет в петарду 12 и сквозь хвостовую часть трубки в разрывной заряд снаряда и разорвет его тотчас же по вылете, произведя картечный выстрел. Если нижнее дистанционное кольцо поставить на Уд (удар), то очко а нижнего кольца придется против перемычки в (фиг. 2) верхнего кольца, горепие из верхнего кольца не передастся в нижнее, и снаряд разорвется только при ударе о препятствие от действия ударной части. 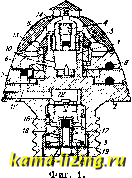 Если повернуть нижнее дистанционное кольцо так, чтобы конец его состава г пришелся против конца дистанционного состава верхнего кольца д, то при воспламенении огонь через очко б передастся верхнему составу, а когда оп весь сгорит, перейдет   Фиг. 2. К нижнему и по сгорании передастся петарде. Это составляет наибольшее время дистанционного горения данной системы трубки. Деления шкалы нанесены на боковой поверхности дистанциоииой части и рассчитаны т. о.,что каждое деление увеличивает дальность разрыва на 30 ж. Деления на нилс-нем дистанционном кольце трубки соответствуют прицелу (дальности). Для придания дистанционным составам равномерности горения, к-рая обеспечивает правильность действия трубки, верхняя плоскость тарели и нилснее кольцо оклеены сукном. При смещении снаряда разрезное конич. залсимное кольцо 13 вгоняется, как клин, в выемку верхнего дистанц. кольца и на время полета крепко прилсимает дистанционные кольца к тарели, что обеспечивает нижнее дистанцион. кольцо от сдвига и сохраняет приданную трубке установку. Для устранения давления газов, которое могло бы, ускорить горение дистанцион. составов, газы выводятся через каналы 14 нарулсу. Ударная часть трубки состоит из ударника 15 с капсюлем, разгибателя 16 и предохранителя 17, соединенного с ударником лапками 18; вверху канала укреплено жало. Снизу в хвост ввинчена втулка с отверстиями для пропуска газов. При выстреле разгибатель 26 по инерции сжимает поддерживающую его пружину, и лапки 18 садятся на ударник; лапки, сжатые разгибателем, разгибаются вновь и соединяют ударник с разгибателем в одно целое. Чтобы во время полета ударник не сдвинулся вперед и не накололся о жало, он у дна хвоста удерживается лапками донной втулки 19, захватывающими за борта прилива ударника. При ударе о препятствие ударник но инерции отрывается от дна, накалывается о жало и зажигает петарду 12, пламя к-рой передается через петарду 20 в центральную трубку снаряда и его разрывному заряду. Лит.: Нилус и Марке вич, Полный курс артиллерии, ч. 2, П., 1916; Руководство службы при 76-л1л* пушках, отд. 5>-Боевые припасы, Москва, 1927 (изд. офиц.); Взрыватели и трубки, изд. Главного артиллер. управления. П., 1915; Агту Ordnance*, Washington, 1926-27. В. Юхневич. ДИСТИЛЛЯЦИЯ, см. Перегонка. ДИСУЛЬФОКИСЛОТЫ, соединения ароматического ряда, являющиеся либо непосредственно промежуточными продуктами для синтеза красящих веществ либо ступенями к ним. Д. получаются при действии серной к-ты 66° Вё или дымящей серной к-ты с различи, содержанием серного ангидрида на ароматич. углеводороды и их амины, фенолы, хиноны и т. д. Из производных бензольного ряда техническое значение имеет л1-дисульфбкислота бензола, переходящая при щелочном плавлении ее в резорцин. Наибольшее значение в технике имеют Д. нафталина и его производных. Из числа возможных изомеров Д. нафталина наибольшее значение имеет 2, 7-дисульфокислота, являющаяся промежуточной ступенью для получения различных азо- и диазокомпонентов Д. нафтолов; в частности 3, 6- и 6, 8-дисуль-фо кислоты /5-нафтола, называемые R-кис-л о т о й и G-K и с л о т о й, получаются при сульфировании /3-нафтола и находят широкое применение в синтезе азокрасителей. Д. нафтиламииов, напр, 3, 6- и 3, 7-дисульфо-1 ислоты а-нафтиламина, называемью к-тами Ф р е й н д а, и 4, 6- и 4, 7-дисульфокислоты а-нафтиламина, называемые к-тами Даля, также находят применение в технике. Весьма большое значение имеют Д. аминонафто-лов, из к-рых нужно отметить Чикаго-кислоту 2S (1, 8-аминонафтол-2, 4-ди-сульфокислота) и гл. образ. Н-к и с л о т у (1,8-аминонафтол-3,6-дисульфокислота), весьма широко применяемую при синтезе различных азокрасителей. Аналогичная ей 1, 8-ди-оксииафталин-3, 6-дисульфокислота, называемая хромотроповой кислотой, применяется для синтеза хромировочн. азокрасителей (см. Хромотропы). Все эти кислоты получаются либо непосредственным сульфированием производных нафталина либо соответствующей обработкой нафталиновых сульфокислот и их иитропроизводных. д. аитрахинонового ряда, в зависимости от их способа получения, являются либо )3-производпыми, если сульфирование ведется при обычных условиях, либо а-производ-ными, если сульфирование ведется в присутствии ртутных солей. Первые, гл. обр., 2, 6- и 2, 7-дисульфокислоты антрахинона, сопутствуют /?-сульфокислоте антрахинона, получаемой для переработки в ализарин, н м.б. отделены от нее, а также друг от друга, благодаря различной растворимости свободных к-т и их солей. При щелочи, плавлении Д. переходят в соответствующие триокси-антрахиноны: изопурпурин и фла-вопурпурии, выпускаемые в продажу под названием ализариновых красных разных марок; а-дисульфокислоты антрахинона (1,5- и 1,8-) и смешанные а- и /3-производные служат исходными продуктами для получения различных галоидопро-изводных и аминов, необходимых для синтеза нек-рых антрахиноиовых протравных и кубовых красителей. Об условиях сульфирования и свойствах Д. см. лит. Лит.: W i с h е 1 h а U s Н., Sulfurieren, Alkali-schinelze d. Sulfosauren, Esterifizieren, Leipzig, 1911. Cm. также лит. к ст. Динитропродукты. И. Иоффе. ДИФЕНИЛ, см. Бифенил. ДИФЕНИЛАМИН, CeHg-NH -СеНз,бесцветное кристаллич. тело, получающееся при нагревании анилина и сернокислого анилина до 150-200° в автоклаве в течение ок. 10 час. Д. в воде нерастворим, растворяется в серной к-те, спирте, эфире и бензоле, обладает приятным своеобразным свежим запахом грибов; Д. является весьма слабым основанием: соли его легко разлагаются действием воды. Производное Д., гексанитроди-фениламин, получают нитрованием Д. и применяют как взрывчатое вещество. ДИФЕНИЛМЕТАНОВЫЕ КРАСИТЕЛИ, красящие вещества, отличающиеся наличием в них двух бензольных ядер, замещающих водородные атомы у центрального метанового углерода. К красгггелям с указанной группировкой м.б. отнесены и те красители, в к-рых эта группировка является частью сложного гетероциклического (как, наприм., ксантоновые, акридиновые) или циклического соединения (как антрахинонные), но химические свойства и практич. применение которых заставляет рассматривать их как производные соответствующих щгклов. Собственно Д. к., шляющиecя по химической классификации метилеихинонными красителями, не имеют большого практического применения, кроме аурамина (I) и родственных по строению с ним кетой а Михлера(11)и гидрола Михлера (III), взаимно друг в друга переходящих. (CIWN - <( > - с - / > - N(CH,)j. HCl - II - (СД3)2N - < > - с - < > -N(CH,). (II) 3> - N(Cn,)j (CH,).N - < > - С - (I Н OH (III) Ауралшн был получен впервые Каро из кетона Михлера при действии на последний аммонийных солей в присутствии хлористого цинка. Более поздний синтез, основанный на действии серы и хлористого аммония в присутствии хлористого натрия на тетра-метилдиамидодифенилметан, был предложен Зандмейером и имеет в настоящее время широкое применение. Кетон Михлера м. б. получен либо из аурамина, полученного по методу Зандмейера, либо при непосредственном действии фосгена на диметиланилин. Лит.: I е о р г и е в и ч Г. и Г р а н м у ж е п е.. Химия красящих веществ, м., 1916; F i е г zD а V i d Н. е., Kunstliche organ. Farbstoffe, В., 1926; В u с li е г е г Н. Th., Lelirh. d. Farbenchemie, 2 АиП., Lpz., 1921; с a in J. С, The Manufacture of Dyes, L., 1922; Rowe, Colour Index. N. Y., 1924. И. Иоффе. ДИФЕНИЛОВЫ Й ЭФИР,окись фенила, фе-нилоксид, CgHg-O-CeHs, применяется в мы-ловаренно-парфюмерном производстве для получения запаха листьев герани, особенно в дешевых изделиях. Получается Д. э. многими способами, из к-рых главнейшие: нагревание фенола с хлориствп цинком или хлористым алюминием, сухая перегонка фенолята алюминия, пропускание паров фенола над окисью тория при t° 390-450°, нагревание фенолята натрия с бромбензолом в нрисутствии меди, сухая перегонка фенолята калия с сульфобензойной к-той, нагревание сульфодиазобензола с фенолом. Д, э.- кристалл, вещество с 1°пл. 26,9° и 1°кип. 259°,
|