
 |
|
|
Литература --> Изомерия в производственном цикле мало влияющие на величину К (напр. термометр), могут не приниматься в расчет. Вычисление водяного эквивалента термометра вызывает вообще затруднения. У хороших калориметрич. термометров (напр. изготовленных Baudin и Tonnelot в Париже) вес ртути обозначается на самом термометре. В сплошных термометрах (с наружными делениями на толстостенном капилляре) вычи-.сления облегчаются тем, что теплоемкости 1 см стекла и ртути приблизительно одинаковы; измеряя объем V погруженной в жидкость части такого термометра, найдем, что его водяной эквивалент равен 0,46 V.. Вообще же лучше всего определять водяной Э1свивалент калориметра при данной арма-туре.вводя в него точно известное количество тепла и измеряя вызванное этим повышение темп-ры Д*. По ур-ию (2) () = (Го + Жс)Д , (3) откуда, если Q-известно, 1Го = -Жс Введение определенного количества тепла, т. е. градуировка калориметра, м. б. произведено тремя способами. 1) При помощи какого-либо тела (т. н. калорифера) известной теплоемкости и массы (Ci,mi), нагреваемого до определенной 1° = в и затем помещаемого в калориметр; тогда = mi-Ci-(6 - у, где конечная t° калориметра, находимая по t°-HOMy ходу, т. е. с поправкой на теплообмен (см. далее). Так, для грубого определения Ко можно воспользоваться приливанием в калориметр подогретой воды. 2) При помощи хорошо изученной химич. реакции; так, напр., часто определяют Kg калориметра калориметрич. бомбой, сжигая в ней навеску сахара (СгНггОц), для к-рого тепло сгорания с большой точностью определено Ричард-сом (9=3 951,5 са1/г), или бензойной к-ты (9=6 324,5 са1/г при взвешивании в воздухе). 3) Наиболее удобным и точным является электрич. способ определения водяного эквивалента Ко калориметра. Для этого через спираль тонкой проволоки из материала с высоким сопротивлением и весьма малым Г-ным коэфф-том удельного сопротивления (из манганина или нейзильбера) пропускают электрич. ток силой I в течение определенного времени т; падение потенциала Е в спирали при этом измеряют точным вольтметром, вводя поправку на силу тока, ответвляющегося в вольтметр где R-сопротивление вольтметра). Тогда вводимое в калориметр количество тепла Q будет равно т 0,2389 cal. Основной задачей К. является определение -истинного скачка t°, отвечающего выделяемому в калориметре количеству тепла. Чтобы при этом исключить влияние теплообмена с окружающей средой, измеряют (фиг. 1) ход t° калориметра до выделения тепла (АВ), во время него (BE) и после его окончания (EF), измеряя t° через каждые i/a-1 мин. (на фиг. 1 изображена типичная форма этих ходов). Представляя эти три периода графически, определяют на графикеже M(=CD), для чего часто бывает достаточно экстраполировать прямую 1-го и 3-го периода и брать разность их ординат для середины среднего периода. Т. к. этот простой способ подсчета может вызвать при нахождении Д ошибку в 1-3%, давая обычно несколько большее число, то при более точных измерениях пользуются Ньютоновым законом для кинетики охлаждения: -а (t-to), где Z-время, а-константа, t, to-темп-ры калориметра и окружающей среды. Егер и Штейнвер, а таклее Рот дали удобные методы таких более точных подсчетов. Вполне возможно, однако, вовсе исключить теплообмен, простым способом, удобным и при технич. измерениях. Этот способ, состоящий в электрич. определении водяного эквивалента калориметра для каждого 4°-ного скачка, был впервые предложен У. Фишером для термо-химич. измерений и м. б. назван электрокомпенсационным способом. Он состоит в том, что в течение того же промежутка времени, к-рый соответствовал измеряемому *°-ному скачку, в калориметр вводят электрически вполне определенное количество тепла (см. выше), подбирая силу тока
Фиг. 1. так, чтобы был вызван скачок t°, возможно более близкий к измеряемому. Строя целую шкалу таких скачков (напр. через 0,01°), канодому из к-рых отвечает известный тепловой эффект, легко найти тепло, выделенное в любом опыте, т. к. калориметр теперь улсе проградуирован; при этом не только исключается теплообмен, но и термометр играет роль только как бы нулевого инструмента (абсолютные значения делений шкалы термометра м. б. неизвестными). Кроме нагревательного калориметра, употребляются адиабатические и изотермические калориметры. Принцип адиабатического калориметра Гольмана-Ричард-са (Holman-Richards) состоит в том, что во все время работы калориметра в наружной водяной оболочке поддерживается та же t°, что и внутри калориметра, чем и исключается теплообмен с окружающей средой. Это достигается, напр., тем, что в наружной оболочке, окружающей калориметр (фиг. 2) по возможности со всех сторон, вызывают химич. реакцию, выделяющую тепло (напр. нейтрализация слабого раствора щелочи к-той, приливаемой из бюретки В), или пропускают электрич. ток, регулируя это компенсирующее выделение тепла соответственно с ходом Г внутри калориметра, т. е. следя 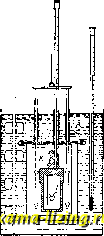 Фиг. 2. чтобы Г внутри калориметраКяв оболочке А были возможно более близкими. Подобные калориметры служили Ричардсу для весьма точных измерений. Изотермические калориметры особенно удобны тем, что в них выделение тепла происходит при постоянной Г. Эту же t° имеет и внешняя оболочка калориметра, и, так. обр., принципиа.чьно теплообмен м. б. вовсе исключен. Поэтому изотермич. калориметры пригодны осо-. ни и бенно для измерения I j I . медленно протекающих тепловых эффектов (при медленных процессах). Изотермические калориметры обычно бывают основаны на явлениях скрытой теплоты перехода из одного аггрегатного состояния в другое. Так, в наиболее часто применяемом при точных измерениях ледяном калориметре Германа-Бунзена, работающем при 0° С, внутренний сосуд (тонкостенная пробирка Р) окружается водой И(фиг. 3), и на его внешних стенках при помощи вводимой внутрь холодильной смеси намораживается слой льда Е. Измеряемое тепло выделяется во внутренней пробирке Р и идет на расплавление части льда; при этом происходящее во внешнем сосуде W изменение объема системы вода 4-лед измеряется по перемещению замыкающего сосуд W ртутного столбика Q в капилляре R или по изменению веса ртути в чашке, в к-рую погружен конец этого капилляра (при этом, по Бену, 1 cal отвечает 0,01546 г ртути). Весь калориметр помещается в ящик А, наполненный чистым снегом или толченым льдом, служащий внешней оболочкой с той же t°. Несмотря на это, практически оказьшается необходимым и в ледяном калориметре принимать во внимание малый непрерывный ход ртутного Я столбика в капилляре. Фиг. 3. таком же принципе устраиваются и менее употребительные паровые калориметры. Калориметры технические. В технике калориметрами пользуются б.ч. для определениятеплотворной способности горючего и калорийности пищи, т.е. для определения теплоты горения соответствующих веществ. При этом навески твердых и жидких веществ сжигаются в т.н. калориметрич. бомбе (помещаемой в воду калориметра), в замкнутом пространстве, наполненном кисло- 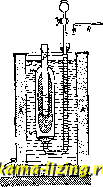 родом под высоким давлением в 20-25 atm. Вместо обычной бомбы Вертело (Лангбейна, Малера, Крекера-см. Бомба калориметри-чеакая) теперь распространено . применение такой же бомбы Рота, сделанной из нержавеющей крупповской стали (V2A). Рот рекомендует делать также внутреннюю оболочку из серебра, бромированного с поверхности (т. е. из AgBr). Применяются и микробомбы с внутренним объемом в 20 см. Чтобы не пользоваться для сжигания газообразным кислородом под высок, давлением, Парр смешивает с сжигаемым веществом избыток сильно действующего окислителя- перекиси натрия (NagOg) в порошке. Этот метод применяется гл. обр, для определения те-плотворн. способности углей. Горючая смесь помещается прямо на дно цилиндрич, бомбочки, помещаемой в водяном калориметре (2 л воды) и являющейся одновременно мешалкой. Воспламенение смеси совершается раскаленным железным стерженьком, вводимым в бомбу через специальный клапан. Водяной эквивалент одинаков для всех выпускаемых в продажу приборов: Kf, = 123,5 cal/град. Для определения теплоты горения (теплотворной способности) горючих газов обычно применяется калориметр Юнкерса, Газ, средняя установившаяся скорость вхождения которого в аппарат V л/мин, точно измеряется лабораторным газомером (см.), сжигается в горелке Бунзена а (фиг. 4). Продукты сгорания, проходя через прибор, отдают полностью развивающееся при сгорании тепло (для контроля служит термометр 1 у выхода) воде, к-рая протекает в обратном току газов направлении, поступая в А к вытекая через Е; установившаяся t° воды при входе и выходе измеряется термометрами li и 2 (с делениями в Vio°) Если скорость течения воды W г/мин, а установившаяся разность t° между li равна Af, то теплотворная способность газа 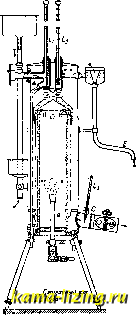 Фиг. 4. cal/л. Если для более точного подсчета учесть количество конденсирующейся при сгорании газа воды (п г/мин) и водяной эквивалент калориметра К (обычно малый), то, приводя к литру газа, измеренного при 0° и 760 мм ртутного столба, получим: Q (W + g) А{ - 0,6п 273 + t 760 V 273 р где t и р-темп-ра и давление поступающего горючего газа. Для определения К при точ- ных измерениях, калориметр градуируется сжиганием в нем сухого чистого водорода; при этом на 18,016 г образующейся воды выделяется 68 340 cal, Т, к, величина К мала, обычно можно считать, что, при постоянном отношении скоростей газа и воды, Q всегда пропорциональна Af, При этом оба термометра ll и Iz можно заменить одной термопарой, показания к-рой (в mV или прямо в са1/г) могут передаваться на регистрирующий аппарат. На таком же принципе основан применяющийся в С. Ш. А. калориметр Бойса. Лит.: Лугинин В. Ф.и Щукарев А. Н., Руководство к калориметрии, М., 1905; его же. Описание различных методов определения теплот горения органич. соединений, М., 1894; Хвольсон о.. Курс физики, т. 3, Берлин, 1923; N е г п s t W., eZtschr. 1. physikalische Chemie , Lpz., 1888, B. 2; A г n d t K., Handbuch d. physik.-chemischen Technik fur Forscher u. Techniker, 2 Aufl., Stg., 1923; White P. W., The Modern Calorimeter, New York, 1928; Berthelot M., Thermochimie. t. 1-2, P., 1897; F i s с h e r U., Ztschr. f. anorgan. u. allgem. Chemie , Lpz., 1905, B. 52, p. 551, B. 59, p. 552; Roth W. A., Ztschr. f. Elektrochemie , Halle a/S., 1910, B. 16, p. 654, 1911, B. 17, p. 789; Fischer E. u. Wrede Fr.. Zt4chr. f. physik. Chemie , Lpz., 1909, B. 69, p. 218; S с h 0 11 к у Н.. ibid., 1913, В. 86, p. 425; Nernst W. u. Lindemann, Sitzungsberichte d. KOnigl. Preu.ss. Akademie d. Wissenschaften zu Berlin*, Berlin, 1910; Magnus A., Physikalische Ztschr. , Lpz.. 1913, Jg. 14; E иск en A., ibid., 1909, Jg. 10, p. 586; Cohen E. u. Moesyeld A. L. Th., Ztschr. f. physik. Chemie . Lpz., 1920, B. 95, p. 305; Richter, Ztschr. f. Instrumenten-kunde , В., 1912, В. 32. p. 177, 234; Junkers, ibid., 1895, B. 15. p. 408; Roth W. A., Ztschr. f. Blektrochemie*. Leipzig, 1924, B. 30. p. 417. 607; Lieb. Ann. , 1915, B. 407. p. 134; W a r t e n b u г g u. H u s e n, Z. ang. Ch. , 1925. Jg. 38, p. 184; Parr, Journ. Amer. Chem. Soc. , Wsh., 1900, v. 22. p. 646, 1902. V. 24, p. 167, 1907. v. 29, p. 1606, 1915, v. 37, p. 2515. П. Ребиндвр. КАЛОРИФЕР, прибор для нагревания воздуха, применяемый для целей отопления, вентиляции и сушки. Принцип устройства К. заключается в нагревании воздуха при его движении около горячих стенок каналов или труб, внутри к-рых движется горячая среда. Такой средой служат раскаленные продукты горения, пар или горячая вода, в зависимости от чего К. делятся на о г-невые, паровые и водяные. Теплота передается от горячей среды воздуху через стенку двояким образом: 1) непосредственным соприкасанием воздуха с горячими стенками и 2) лучеиспусканием. Лучеиспусканием выделяется довольно значительная часть тепла, но т. к. вся система каналов или труб заключена в кожух, то это теп-то не рассеивается в наружное пространство, а используется внутри камеры или кожуха для нагревания воздуха, чем повышается полезное действие прибора. Огневые К. В общем случае огневые К. представляют собою печь с обыкновенным топливником, откуда горячие газы проходят через систему каналов или труб, а затем удаляются в дымовую трубу. Каналы или трубы расположены на нек-ром расстоянии друг от друга и заключены в общий футляр или кожух, образуя замкнутое пространство. Нагреваемый воздух входит в кожух через отверстия, сделанные снизу, нагревается и уходит через верхние отверстия по отводным трубам. Передвижение воздуха происходит благодаря уменьшению веса единицы его объема при нагревании, что заставляет воздух двигаться вверх. Нагревательные каналы или трубы, а также кожухи делаются металлич. или кирпичные. По этому принципу различают К.: 1) малой теплоемкости, имеющие металлич. нагревательные поверхности, и 2) большой теплоемкости, с кирпичными нагревательными поверхностями. I. Огневой К. малой теплоемкости (фиг. 1) представляет собою тип комнатного чугунного К. для топки каменным углем: а-топочи, дверцы, б-дверцы зольника, в-дверцы, открываемые тогда, когда хотят продолжать топку без возобновления воздуха, г-заслонка (клапан), для закрывания отверстия, доставляющего свежий воздух через подпольный канал, д-заслонка для закрывания печи по окончании топки. Топливник имеет кирпичную облицовку, во избежание сильного раскаливания стенок. Кпд таких К. крайне мал, так как раскаленные топочные газы быстро уходят через трубу наружу, нагревая только тонкую металлическую стенку с незначительной теплоемкостью. Камерный К. с металлич. ребристыми трубами и кирпичным кожухом представлен на фиг. 2: а-каналы из чугунных ребристых труб, б-канал для дополнительного впуска воздуха, в-прослойка песка для более плоти, соединения труб с кладкой, г-вычистные дверцы. 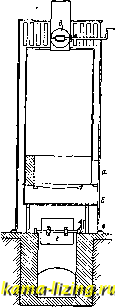 Фиг. 1. -дымовые 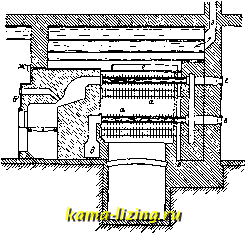 Фиг. 2. д-боров в дымовую трубу, е-сосуд для ув-лаиенения воздуха, ж-воронка для наполнения сосуда, 3-хайло жарового воздушного канала. Концгл труб, прилегающие к топ-
|
||||||||||