
 |
|
|
Литература --> Изомерия в производственном цикле нагревают до кипения и кипятят точно 2 минуты. По количеству выпавшей закиси меди, по табл. Мейсля (Meissl), определяют количество И. е. [j. Между вьшавшей медью и И. с. существует такое соотношение: у=~ 1,0845 + 1,9864ж -0,0008978 я;2, где у-количество меди в мг, х-количество И. с. в мг. И. с. является легко усвояемым пищевым продуктом, содержится в плодах, ягодах, овощах и пр., служит материалом для приготовления искусственного меда. Присутствие технич. И. с. в меде открывается при помощи реакции Фиша (Fiche), для чего несколько г меда растирают в ступке с эфиром, эфирную вытяжку сливают, дают эфиру улетучиться при комнатной Гик остатку прибавляют несколько капель свежеприготовленного 1%-ного раствора резорцина в конц. НС1. В присутствии технич. И. с. получается оранжевое, переходящее в вишневокрасное окрашивание. Эта реакция основана на том, что при инвертировании сахарозы к-тами продукт распада левулозы, Д-окси-<5-метилфур-фурол, дает хщетную реакцию с резорцином. Лит.: ) L i р р m а п п Е., Die Chemie d. Zucker-arten, 3 Aufl., Halbband 2, p. 1261 u. ft., Lpz., 1904; *) Д e M ь я H 0 в Н. Я., Общие приемы анализа растительных веществ. Агрономич. химия, стр. 75-88, М.-П., 1923. И. Щербаков: ИН ДАНТРЕН,правильнее индантрон, синий антрахинонный кубовый краситель (см.), обладающий выдающейся прочностью к мытью и свету; по химич. строению он представляет собой диантрахинондигидро-азин строения (I) 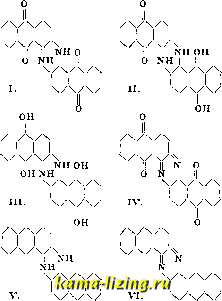 И. был впервые получен Р. Боном р] в 1901г. при сплавлении )8-аминоантрахинона со щелочами. Этот путь получения И. оказался наиболее удобным и для технич. производства. В нагретый до 250° плав едкого кали вносят по частям -аминоантрахинон в количестве /з от взятого едкого кали и при размешивании нагревают аса при 250° Р,з]. Плав разбавляют водой и осанедают содержащуюся в нем калиевую соль лейко-соединения И. продуванием воздуха. Выпавший в осадок краситель очищают растворением в щелочном растворе гидросульфита, и из фильтрованного раствора осаждается либо лейкоиндантрен поваренной солью либо готовый краситель продуванием воздуха. Степень чистоты И. сильно влияет на его прочность к хлору и окислителям. При этом методе выход И. составляет 48% теоретического. Некоторые патенты предлагают добавлять окислитель в плав И., но целесообразность этого не подтверждается экспериментальными данными, тем более что часто добавление окислителя вызывает бурную, доходящую до взрыва, реакцию. В плаве И. всегда присутствуют в различных количествах ализарин и флавантрен. Соотношение их количеств зависит от t° плава: более низкая t° способствует образованию ализарина, более высокая (310°)-образованию флавантрена. Объяснение их совместного образования по Швенку см. [*]. Лучшие выходы И., близкие к количественным, получаются при конденсации двух молекул 1-амино-2-бромантрахинона внитро-бензольном или нафталиновом растворе (по Ульману) в присутствии безводной уксусно-натриевой соли и каталитически действующего медного порошка []. Для И. этот синтез имеет лишь теоретич. интерес, подтверждая строение И. Высокая же стоимость исходного продукта не позволяет этому способу конкурировать с методом щелочного плавления /8-аминоантрахинона. Из остальных синтезов И. следует отметить [*] метод действия хлора на а-аминоантрахинон при 220°. Целый ряд синтезов И., не имеющих технич. значения, см. Интересна рабо- та Р. Люлека [], имеющая пока только теоретический интерес. 48%-ный выход И. при щелочном плавлении является побуждающим стимулом для дальнейшего усовершенствования метода щелочного плавления, и исследование в этой области продолжается. И. может давать два различных лейкопро-дукта (Пи П1) и продукт окисления, имеющий строение азина (IV). Первые два переходят обратно в И. при действии кислорода воздуха, последний же-при умеренном восстановлении. При действии сильных восстановителей И. переходит в антраценовое производное (V), к-рое при окислении образует не И., а азин строения (У1). Более глубокая окраска лейкосоединения (II) и продукта окисления (1У) является интересным материалом для объяснения связи между строением и цветностью [J. И. обладает выдающейся прочностью к свету и мытью, но его прочность к окислителям, и особенно к хлору, заставляет желать лучшего. Нек-рые га-лоидопроизводные И. поступающие в продажу под названием И. синего GCD, обладают более повьпиен. прочностью к хлору. И. и его производные являются весьма распространенными -кубовыми красителями и находят применение не только в,печати и крашении, но и в литографском деле для замены мало прочного ультрамарина. Серьезными конкурентами И. являются т е т р а-бром индиго, гидр о.н-синий и пи-рогеновый синий. В последнее время И. стал собирательным термином для ряда кубовых красящих веществ, отвечающих определенным требованиям прочности. К индантреновым красителям относятся: 1) ациламиноантрахиноны, как ин-дантреновый желтый SK, представляющий дибензоил - 1,5-диаминоантрахинон, и ряд других; 2) антримиды, как индантреновый бордо В, получаемый конденсащгей (по Ульману) 1,5-дихлорантрахинона с /?-аминан-трахиноном и др.; 3) красители, содержащие конденсированные антрахинонные ядра, как виолантрен (см.) и другие производные бен-зантрона (см.), пирроновые и периленовые производные; 4) красители, содержащие ге-тероциклич. ядра, как собственно индан-трен, содержащий дигидроазиновое кольцо, антрахинон-акридоны, антрахинон-ксан-тоны, антрахинон-тиоксантоны и антрахинон-карбазолы. Лит.: 1) в , 1903, В. 36, р. 930, 1910, В. 43, р. 999; ) F 1 е г z-D avid Н. Е., Kunstliche orga-nische Farbstolfe, В., 1926; ) Cain J. a. Thorpe J., The Synthetic Dyestuffs, L., 1923; ♦) de В ar-ry Barnett E., Anthracene a. Anthraquinone, N. Y., 1921; )Г.П. 158287; F г i e d 1 a e n d e г P., Fortschritte d. Teerfarbenfabrikation u. verwandter Industriezweige, T. 8, p. 531, В., 1921; ) Fried-1 a e n d e r P., ibid., T. 1-15, В., 1920-28; ) L u-1 e с к R. N., Joiirn. of the Amer. Chem. Society*, Wsh., 1927; ) S С h о 1 1, В , 1903, В. 36, p. 3410, 3437, 3710, ibid., 1907, В. 40, p. 424; ) Г. П. 287590, 234950/24. И. Иоффе. ИНД EH CgHg, жидкий углеводород, открытый во фракциях сырого бензола, кипящих при 176-182°; молекула И. состоит из двух конденсированных ядер - бензольного и пятичленного-пентадиена 1 и. представляет собою светложелтое масло с 179,5 -180,5°,/,°з рз.-2°, УД. в. 1,002-1,008; на воздухе неустойчив, окис-.тается и превращается, особенно быстро при нагревании, в полимеризованный продукт. И. обладает слабо кислым характером; водород группы С На может легко замещаться щелочными металлами; так, при нагревании до 100° с натрием или амидом натрия, И. дает соль - натрий-инден C9H7Na. Для И. характерен трудно растворимый пи-крат, кристаллизующийся в желтых иглах; им пользуются для выделения индена (при сильном охлаждении) из каменноугольного дегтя и светильного газа. И. может быть получен также и синтетически различными способами; удобнее всего его приготовлять из гидрокоричной кислоты. Из производных и. наиболее важны: ги др- /\. сн, инден I I находящийся также \/\/ В каменноугольном дегте, синтетически получаемый восстановлением И. натрием в спиртовом растворе; метил- и диме-т и л-и н д е н, находящиеся во фракциях каменноугольного дегтя, кипящих при 220-230°. И. еще не нашел себе технич. применения; его полимеризованный продукт применяется при производстве лаков. ИНДИГО, синий кубовый краситель, являющийся родоначальником класса и н д и-гоидных красящих веществ. И. в чистом виде, называемое индиготином, имеет химическое строение: I i с=с I I \/\ш1/ Чн/\/ и представляет собой синий кристаллич. порошок, бронзирующий при растирании, нерастворимый в воде, водных к-тах и щелочах, мало растворимый в спирте. И. хорошо растворимо в кипящем анилине, нитробензоле, феноле, нафталине и особенно во фта-левом ангидриде, из к-рого кристаллизуется в крупных синих призмах. И. растворяется с сине-зеленым цветом в крепкой серной к-те и при стоянии или нагревании раствора переходит в сульфокислоты И. И. легко восстанавливается в б е л о е И. строения: II с-с , I I \/\nh/ Чн/\/ а при действии окислителей переходит в изатин (см.). Более подробно физич. и химич. свойства И. см. []. Вышеприведенная структурная ф-ла И., предложенная А. Байером, до сих пор еще не встретила единодушного признания, хотя характерная полу-хинонная группировка и легла в основу классификации индигоидных красящих веществ (см.). Нек-рые свойства И., гл. обр. его мономолекулярность как в парах, так и в растворе, несмотря на наличие весьма реакциеспособной к галохромным (см. Гало-хромил) присоединениям карбонильной группы, заставили предположить, что в молекуле И. имеют место внутримолекулярные связи между карбонильными и имидными группами. М. Клаш (М. Claasz) [} предложил для И. ф-лу 6 с=с о к-рая не вполне соответствует нерастворимости И. И. Лифшиц и Г. Лури [] видоизменили вышеприведенную формулу, приняв галохромную связь за счет остаточных сродств кислорода карбонильной и имид-ной групп. В. Маделунг [J для объяснения стойкости молекулы И. предполагает, что в молекуле И. имеется связь между карбонильной и имидной группами разных ядер, обусловливающая образование двух новых циклов, почему он и придает И. строение /\/\ / Ч/Ч I I с=с I I с наличием двух ортохиноидных ядер; при этом предположении И. есть производное транс-формы дибен- аоилэтилена f-СО-СН=СН-СО-1. Формулу В. Маделунга можно видоизменить, заменив связи между карбонильными и имидными группами соответственно галохромным представлениям. Окончательное установление ф-лы строения И. принадле-. жит будущему. До конца 19 века И. представляло собой продукт исключительно естественього, растительного происхождения, получавшийся в больших количествах из индигоносных растений (индигоноски, семейства мотыльковых)-Indigofera tinctoria, Isatis tinctoria, Polygonium tinctorium и друг., в зеленых листьях и стеблях к-рых И. находится в виде глюкозида и н д и к а н а; содержание ин-дикана в стеблях доходит до 0,2%, в листьях-до 0,5%. В виду того, что наиболее богатые И. культуры растений выращивались в тропич. колониях (Ява, Филиппинские острова, Ост-Индия и др.), естественное И. носило также название колониального И. На юге России, а также в средней Германии культивировалось (преимущественно в средние века) индигоносное растение Isatis tinctoria, т. н. в айда И, но содержание И. в нем было незначительно по сравнению с тропич. культурами, и культура вайды не выдержала конкуренции с колониальным И. Выход И. при получении его из колониальных растений колеблется от 0,1 до 0,4% от веса сырого растения, в зависимости от культуры и условий переработки. Для выделения И. из содержащегося в листьях и стеблях растений глюкозида свежесрезанные зеленые части растения помещают в специальные ямы, заливают водой и оставляют для брожения. Процесс сбраживания сопровождается усиленным выделением углекислоты и длится 12-24 ч. При этом углевод глюкозида разрушается, и носитель П.,по всей вероятности-производное индоксила (см. ниже), переходит в раствор, окрашивая его в желтый цвет. Полученный в бродильных ямах желтый раствор сливают в чаны, где при непрерывном помешивании он окисляется пропусканием воздуха; при этом индоксильное производное окисляется в И., и последнее в виде синих хлопьев выпадает в осадок, к-рый отфильтровывают, промывают, отжимают на прессах и сушат, придавая ему форму, характерную для каждого сорта колониального И. Содержание индиготина в различных сортах колеблется от 90% (в лучших сортах бенгальского И.) до 10-15% (в худших сортах И. из вайды или И. эквадорского) [*]. Из примесей естественного И. следует отметить частицы древесины, попадающие при брожении, различные фальсифицирующие и наполняющие вещества, а также и получаемые вместе с И. красящие вещества, из к-рых главным является индигорубин, или и н д и р у-о и п (см. Индгьгоидпые красящие вещества). Качество естественного И. определяется либо пробными выкрасками либо чисто химич. путем [Ц. Применение естественного И., начавшееся в древнеисторич. времена, продолжается до наших дней, и лишь победоносное развитие производства искусственного И. в начале 20 в. сильно повлияло на уменьшение потребления и производства естественного II. В 1900 г. мировая продукция естественного И. оценивалась в 40 млн. р. при цене его от 2 до 10 р. за кг. Громадное потребление естественного И. поставило перед химией задачу изыскать пути синтетич. получения И. Этой задаче должна была предшествовать другая-изучение и установление строения И. Честь разрешения обеих задач принадлежит Адольфу Байеру [8]. Исходным продуктом первых работ Байера бьш изатин; при перегонке изатина с цинковой пылью при высокой t°, Байер получил в 1868 г. новое вещество, названное им и н д о л о м (I), к-рое он назвал основным веществом ( Muttersubstanz ) И. Вслед за этим Байер в ряде работ получил и исследовал различные производные индола, к которым он отнес и И. Т. о. были получены: оксиндол (III) и диоксин-дол (IV), исследованы: изатин (V) и изомерный с оксиндолом индоксил (II), единственное соединение, к-рое, в отличие от всех остальных кислородных производных индола, при окислительном действии кислорода воздуха переходит в И. Т. о. была доказана генетич. связь И. с индолом и было предполож;ительно указано строение И., что выражается в следующей таблице: он, I. I I сн /\/С(ОН) II. 1 I сн I I или в тау- /\/\ томерной ; I CHj форме \/\ivTu/ или в тау-/\/ С-ОН томерной II С = 0 форме \/\nh С(ОН) илиВ СО / IV. I I С-ОН Ур ( I с / форме i* \/\ NH Ч или в тау-/\/ \ С-ОН томерной II С = 0 форме \/\nh/ Индиго i I С=С ч/\н/ \nh/\/ В 1870 г. Байеру удалось воспроизвести обратный процесс получения И. из изатина. Хотя И. при окислении легко переходит в изатин, но обратный процесс не протекает при непосредственном восстановлении изатина. Лишь действие пятихлористого фосфора переводит изатин в изатинхлорид С-CI к-рый при действии слабых восстановителей, как сернистый аммоний, переходит в И. Этот процесс нельзя еще считать синтезом И., т. к. исходный продукт-изатин-до тех пор являлся продуктом индигового происхождения. В виду этого усилия Байера и его школы были направлены к получению изатина из продуктов неиндигового происхождения. Эта задача была разрешена Байером (1878 г.), и т. о. был произведен первый истинный синтез И. по следующей схеме: GOGH соон-
Первый синтез И. не мог иметь производст-
|