
 |
|
|
Литература --> Изомерия в производственном цикле Табл. 1.-Энергия активации нек-рых простейших реакций (Qi - в cal на г-моль). Реакция Q, без Ктр. Распад N,0 . HJ . NH, Образование H,S . . . . 68 500 44 000 70 000-80 ООО 61 400 QiB присутствии Ктр. 32 500 25 000 39 000 25 750 Катализатор Платина Золото Золото Вольфрам Кислород литич. действие на 7 10 л перекиси водорода; присутствие 10 г нормального раствора CuSOi ускоряет окисление сульфита натрия в сульфат; часто роль Ктр. играют малейшие следы воды и других веществ. В качестве Ктр. в лабораторной и заводской практике употребляются восстановленные металлы (гл. обр. магний, алюминий, марганец, никель, железо, медь, серебро, золото, п.татина, палладий, осмий), металлоиды (сера, фосфор, хлор, бром, иод), окислы, минеральные к-ты, щелочи и многие другие неорганич. и органич. соединения. Способ приготовлея Ктр. влияет на их эффективность; существ, значение здесь имеет характер поверхности, способ получения (мокрым или сухим путем, из тех или иных соединений данного элемента), Г обработки, сушки, прокаливания, наличие примесей. При гетерогенном К. обычно наносят Ктр. на подходящую основу, или подкладку, выбирая для этого вещество с сильно развитой поверхностью (кизельгур, активированный уголь, пемза, силикагель и др.); в частности, подкладкой может служить вещество, из к-рого готовится Ктр. При гидрогенизации над никелем получают хорошие результаты, когда исходная окись его восстановлена не нацело: т. о., здесь Ктр. является никель, распределенный на зе{тах его окиси. В целях получения Ктр. в наиболее раздробленном состоянии пользуются их коллоидньгии растворами (золями); вследствие малой устойчивости последних употребляют обычно золи, защищенные обратимыми (лиофильными) коллоидами. Золи Pt и Pd, защищенные ли-зальбиново- или протальбицовокислым натрием, нашли большое практич. применение (Ктр. Пааля, см. Гидрирование). Связанное с защитой обволакивание частичек Ктр. увеличивает и длительность его действия, понижая, однако, интенсивность последнего. При гомогенном К. известен ряд случаев, когда скорость реакции пропорциональна концентрации Ктр. (напр., скорость разложения диазосоединений в водном растворе пропорциональна концентрации водородных ионов, являющихся Ктр.); однако, как общее правило, эта зависимость более слож:-на. В гетерогенном катализе главными факторами являются строение, характер и специфичность поверхности. Физико-мехаюгаеск. условия-скорость пропускания вещества над Ктр., перемешивание, способ наложения Ктр. на подкладку, размещение Ктр. в реакционном пространстве, скорость диффузии-имеют большое значение. Платина в виде черни, пластинок, тампона, сетки действует по-разному, при чем форма, пригодная для одной реакции (напр. для окисления сернистого газа), не пригодна для другой (напр. окисления аммиака). Эти факторы затрудняют точную воспроизводимость опытов. Макроскопически Ктр. после реакции остается таким же, каким был до начала; наблюдаются изменения лишь поверхностной структуры, напр. появление налетов каталитич. пыли. Общей характеристикой Ктр, является то, что его количество не находится в стехиометрич. связи с количеством прореагировавшего вещества. Это не исключает возможности промежуточных образований, в особенности если принять во внимание цепной механизм К. или быстрое активирование на поверхности. При выборе Ктр. на практике исходят не только из учета его ускоряющей способности (одна и та же реакция м. б. ускорена разными Ктр.), но также принимают во внимание дешевизну, легкость получения, чувствительность и капризность Ктр. к изменению условий. При синтезе аммиака уран, напр., дает хорошие выходы, но обладает недостатком - чувстви-те.льностью к влаге, понижающей его действие; поэтому практически удобнее дешевое и более постоянно действующее железо, несмотря на меньший выход продуктов, получаемых при работе с этим Ктр. В начале действия Ктр. выходы растут, постепенно достигая максимума, но с течением времени изменение структуры, пористости, деформация поверхности от температурных влияний, загрязнения - влекут за собой понижение эффективности катализа. Действие поверхности при К. В случае гетерогенного К. существенны явления, имеющие место при столкновении молекул с Ктр. Принято считать, что при этом происходят изменения физико-химич. порядка, в результате к-рых молекулы становятся более реакциеспособными. Действие Ктр. связано с адсорбцией (см.) и м. б. весьма многообразным. Изучение процессов, происходящих при ударе молекул жидкости или газа о твердую поверхность, долл но помочь выяснить природу К. 1) Удар о поверхность может произойти так, что молекула ориентируется, приближаясь к Ктр. одной своей частью (полярной) и отталкиваясь- другой. Ориентация молсет иметь место для молекул, обладающих электрич. моментом. Поскольку молекулы состоят из э.11ектронов и положительных я дер, возможна структура, при к-рой центры тяжести положительных и отрицательных зарядов не совпадают. Такие мсяекулы дипольны (см. Диполь мол е к у л я р н ы й), т. е. имеют электрический момент О. При адсорбции молекула лежит на поверхности своей полярной группой. Такая; ориентация может способствовать К. При дегидрогенизации алкоголей последние прилегают к Ктр. своей группой CHgOH, при чем в этом месте происходит ослабление связей, активация и отщепление водорода. 2) Действие силового поля поверхности может вызвать деформацию адсорбированной молекулы, т. е. смещение ее электрич. зарядов (поляризацию), в результате чего получается дополнительный электрический момент; такое нарушение нормального состояния способствует активации. Ориентаци-онное и поляризационное взаимодействие может рассматриваться как проявление сил вторичной валентности. 3) При адсорбции незначительных количеств вещества может выделяться много энергии (экзотермичность адсорбции). Так, при поглощении углем первых порций кислорода выделяется 220 ООО са! на г-молекулу О.. Это количество превышает теплоту горения твердого угля (96 ООО cal) и близко к энергии горения газообразного углерода (около 150 ООО cal), вычисляемой из теплоты его возгонки. Это указывает на то, что поверхностные атомы могут удерживаться слабо и быть в полусвободном состоянии. Выделяющееся тепло может служить источником активации. 4) Действие поверхности Ктр. может заключаться в ионизации. Легкость и быстрота взаимодействия ионов хорошо известны. При адсорбции кислорода на платине, повидимому, происходит переход электрона от металла на адсорбируемое вещество. Термоионный эффект (работа вырывания электронов) для платины равен 126 500 cal на г-атом; сродство молекул кислорода к электронам равно 80 500. cal. Если адсорбция заключается в ионизации кислорода за счет электрона платины, то требующаяся энергия составляет 46000 cal, что близко к опытному инкременту энергии 50 000 cal. Такое же соотношение наблюдается и при адсорбции на вольфраме. Ионизируются не все молекулы, ударяющиеся о поверхность Ктр., а только часть их. 5) Адсорбция на Ктр. молгст сопровождаться диссоциацией адсорбированного вещества на атомы; посяедние являются мощными активаторами. Тепловые эффекты реакций, если при расчетах исходить из атомов, значительно превышают энергию, выделяющуюся при взаимодействии молекул. Это объясняется значительной энергией, необходимой для диссоциации молекул (напр., н2->2Н- - 102 ООО cal). 6) Силы, действующие между Ктр. и реагирующими молекулами, принципиально не отличимы от химич. сил. Вследствие неровностей и выступов поверхности Ктр., его поверхностные атомы не имеют окружения, соответствующего внутренним атомам, и могут рассматриваться как образования с ненасыщенными валентностями. При адсорбции могут образоваться временные адсорбционные соединения-комплексы, к-рые не всегда поддаются обнаружению химико-аналитич. путем, вследствие малой длительности их существования и быстрого перехода в устойчивые продукты реакции. Действие металлическ. Ктр. при реакциях с водородом и азотом может итти через образование гидридов и нитридов, существование к-рых доказано спектроскопич. методами. 7) Время пребывания молекулы в адсорбированном состоянии на поверхности Ктр. м. б. достаточно продолжительным. Это дает возможность другим молекулам, налетающим на поверхность, также вступать в реакцию. Такая фиксация молекул на Ктр. увеличивает число столкновений. 8) Специфичность действия Ктр. связана с его химич. структурой. Так, при бромировании этилена активными оказываются такие Ктр, у которых в состав молекулы входит кислород Гстекло, стеариновая к-та, цетиловый алкоголь и др.); на парафине скорость реакции в 17 раз меньше, чем на стекле. Введение про-пилового спирта на парафиновую поверхность при хлорировании приводит к возрастанию скорости. 9) В связи со сложным рельефом поверхности (трещины, впадины, пики атомов) и с активностью не всех, а только части общего числа адсорбированных молекул высказана теория, согласно к-рой на поверхности Ктр. активными являются только некоторые точки (активные центры), при чем места, катализирующие одну реакцию, оказываются инертными для другой. Нагревание, связанное со скольжением атомов и с нивелированием поверхности, уменьшает число активных центров. На одних участках протекает химическая реакция, а на других-лишь обратимая адсорбция. При гидрогенизации этилена эффективна 0,01 поверхности никеля. Количество N молекул, налетающих в ск. на см поверхности Ктр., дается уравнением: 43,75 10- -д , - (10) \/мт где р--давление в барах (~10~*J.<m), Т- абсолютная темп-ра, М-молекулярный вес. Большое значение характера поверхности обусловливает тот факт, что скорость реакции в присутствии Ктр. не определяется однозначно величиной энер вии активации, как видно из разложения Н-СООН на COg и Hg, при различных Ктр. (табл. 2). Табл. 2. -Энергия активации и константы скоростей разложения Н-СООН.
Действие платины и родия эффективнее, чем стекла и золота, хотя энергия активации остается того же порядка. 10) Ктр. оказывает специфич. влияние на ход реакции, обусловливая переход последней через промежуточные стадии. В связи с этим различные Ктр. по-разному ускоряют одну и ту же реакцию. Реакция образования COj и Н. из СО и HjO протекает при 200-300° в присутствии меди; при 400-450° действует лучше окись железа. Причина-та. что в первом случае процесс идет через образование Н-СООН, а во втором-СО окисляется за счет окиси железа. Чередование окислительного и восстановительного процессов на поверхности Ктр. часто способствует сильному каталитич. действию. Обусловливая неодинаковое течение промежуточных реакций, различные Ктр. могут приводить и к неодинаковым конечным продуктам. Разложение СНз-СО.ос2н5 в зависимости от применяемого Ктр. протекает разными путями по ур-иям: I. СН.-С0-0С,Н,-СН,-С0-0Н+СгН4 (Ктр.-TiO): II. СНэ-СО-ОСгН, = СзН8+СОа(Ктр. - измельч. Ni); III. 2CH3-CO-OC,Hs=CH,-CO-CH, + C,h5-OH + CJit+ +GOi (Ктр.-ThOj). Точное экспериментальное определение энергии активации при гетерогенном К. затруднено вследствие изменения характера поверхности и степени адсорбции при изменениях t°. В тех случаях, когда имеются основания полагать, что занята вся поверхность Ктр., энергия активации вычисляется из *°-ного коэфф-та. Как и в случае гомогенного К., активация может происходить за счет кинетич. или внутренней энергии молекул, ударяющихся о поверхность, за счет тепла адсорбции и т. д. Изучение порядка реакции и влияния концентрации на ее скорость позволяет выяс-нитт> характер активации. Если для реакции необходимы молекулы А и В, то возможен случай, когда адсорбируется только молекула А и процесс идет при ударе молекулы В о молекулу находящуюся уже в адсорбированном состоянии. Это-реакция первого порядка, определяемая количеством ударов молекулы В, поскольку адсорбционное равновесие между Ктр. и молекулой А устанавливается очень скоро (процесс не зависит от скорости адсорбции). Если обе молекулы, А я В, реагируют в адсорбированном состоянии, то скорость зависит от возрастающей концентрации, но когда последняя становится такой, что вся поверхность огазывается покрытой (т, е, когда достигается предел адсорбции), дальнейшее повьппе-ние давления уже не меняет концентрахци молекул на поверхности Ктр. и не вл:ияет больще на скорость, т. е. реакция идет по ур-ию нулевого порядка. Этот случай имеет место при гидрогенизации на поверхности металлов, а также в нек-рых реакциях ферментативного характера. К. в растворах зависит от растворителя, от прибавленных электролитов и от их ионов, Повидимому, в растворах происходит образование промежуточных комплексов. Скорость реакции зависит в этом случае не только от концентрации, но и от специально вввдимых коэфф-тов активности веществ, участвующих в реакции. Этими коэфф-тами выразится поправка на отклонение от законов идеальных газов в применении к растворам. Наряду с ускоряющим действием ионов установлено также и влияние недиссо-циированных молекул, при чем ион и молекула характеризуются неодинаковыми константами скорости. Для случаев разбавлен-* ных растворов электролитов коэфф-ты активности вьгаисляются из законов электростатики и мо-яекулярной статистики (закон Больцмана). Специфич. влияние оказывает на энергию активации и растворитель, как это видно на примере реакции между анилином и бромацетофеноном (энергия активации приведена в cal на г-мо.1ь). Растворитель С.И ..... СНС1, .... CHsiVO, . . . C,H,-CHsOH СаН.-ОН . . Энергия активации 8 ООО 10 700 13 470 14 290 13 900 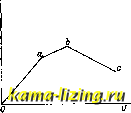 Фиг. 1. Работа катализатора. Если V- объем газов, проходящих через Ктр. в ек., -S-объем Ктр. (расчет ведется по объему в виду невозможности ко;и1чественно учесть величину поверхности), то выражение 17 = = даст количество вещества, соприкасающегося с единицей объема Ктр. в 1 ск. Если из проведенного через реакцию количества и прореагировала часть а, то выход будет равен aU. При небо-льших скоростях пропускания газов реакция успевает за время их соприкосновения с Ктр. дойти до состояния равновесия. С возрастанием U растет до некоторого предела и all, поскольку длительность контакта оказьшается достаточной и величина а-постоянна. На фиг. 1 (ось абсцисс- и; ось ординат-all) эта часть соответствует отрезку Оа. Точка а соответствует максимальному выходу при статических условиях реакции, когда отсутствует циркуляция газов. При дальнейшем росте и начинается падение а, так как вследствие увеличивающейся скорости потока газов через катализатор успевает прореагировать меньшая часть вещества. Выход all все же возрастает, так как уменьшение а компенсируется увеличением U (отрезок аЬ). Точка b указывает наибольший вьгход при динамическом проведении реакции (при непрерывном потоке газов). В случае еще ббльших значений U время контакта становится столь малым, что величина а быстро падает. Это ведет к уменьшению выхода (отрезок be). Слишком медленное пропускание газов через Ктр. практически неудобно; в первые моменты соприкосновения реакция протекает быстро, и дальнейшее задерживание газов над Ктр. мало эффективно. Напр., при продолжительности контакта NH3 и Оз с платиной в течение 0,05 ск. выход достигает 96,1%; увеличение времени контакта в 12 раз (0,6 ск.) дает лишь незначительный прирост выхода в 0,2%. Поэтому технически оказывается выгодным, в известных пределах, увеличивать скорость протекания реакционной газовой смеси, не взирая на проистекающее от этого незначительное падение % выходов, но увеличивая зато нагрузку Ктр. Скорость газового потока нередко уста-нав.71ивают в несколько м/ск. Необходимо также добиваться равномерного наполнения реакционного пространства катализатором во избежание образования свободных каналов, через к-рые газы могли бы проникнуть, не вступая в соприкосновение с ним. Состав пропускаемой газовой смеси определяется раз.личными условиями, в зависимости от стоимости того или иного компонеета и от влияния его избытка на конечный результат реакции. В тех случаях, когда реакция сильно экзотермична, но когда при этом повышение t° выше определенного предела нежелательно (как, наприм., при контактном окислении аммиака), к смеси реагирующих газов примешивают такой избыток воздуха И.ЛИ другого газа, который поглощал бы излишнюю теплоту реакции. Зная тепловой эффект Q реакции и тенчоемкости с всех
|