
 |
|
|
Литература --> Бумажный брак в производстве натр,-согласно следующей формуле: Ca(0H),+Na,C0.=2 NaOH+CaCO,. Применение едкой извести и соды (т. н. содово-известковый способ) является универсальным и в то же время наиболее дешевым способом химич. очистки В. В случае применения подогрева в водоумягчите-ле расход извести уменьшается против показанного в таблице, т. к. при t° очищаемой В. в 60-70° происходит частичное раз-лолсение бикарбонатов кальция и магния с выделением в осадок углекальциевой соли, и, реже (при значительной магнезиальной жесткости)-углемагниевой соли, и с выделением освободившейся угольной кислоты: Са(НС0,), = СаС0.н-С0. + Н,0, Mg(HCO,),=MgCO,+CO.+H,0. Содержащаяся в В. свободная углекислота при высоком подогреве также б. ч. удаляется, соответственно уменьшая потребный для ее связывания расход едкой извести. Выше было упомянуто, что для полноты реакции реактивы должны прибавляться к В. с небольшим избытком. Но если избыток будет слишком велик, то ясно, что в очищенной воде будет избыток едкой извести или большой избыток соды. О нежелательности большого избытка соды уже упоминалось выше; избыток же едкой извести недопустим даже и в самом ничтожном количестве, т. к. гидроокись кальция легко выкристаллизовывается в котле, способствуя образованию твердой, трудно удалимой накипи. Если же одновременно с избытком извести к В. прибавлено достаточно соды, то образуется гидрат окиси натрия; последний допустим в очищенной В. не больше 0,5 нем. градуса. Если, наоборот, извести подано меньше соответствующего содерлеания в В. бикарбонатов, магнезии и свободной углекислоты, то в воде остаются бикарбонаты, дающие в котле углекислый газ, разъедающий котельное железо, особенно энергично в момент своего образования. Кроме углекислоты из бикарбоната кальция выделяется карбонат кальция, сильнее пристающий к котельным стенкам в виде твердой накипи также в момент своего образования. Если, наконец, подано соды меньше потребного количества, то вода-недоочищена, и в ней остается соответственная часть небикарбо-натных накипеобразователей, что так же вредно, как и избыток едкой извести. Отсюда ясно, что водоочиститель должен обеспечивать постоянство и правильность подачи реактивных растворов в тех весовых взаимоотношениях, которые показаны в табл. 15. Это является одним из основных требований правильной постановки водоочищения. При целесообразном применении перечисленных выше реактивов можно в подавляющем большинстве случаев получить безукоризненную питательную В. Едкий натр редко комбинируется с известью; чаще он применяется в комбинации с содой. В последнем случае едкий натр реагирует со свободной углекислотой и с бикарбонатами, при чем в осадке выделяются СаСОз и Mg(0H)2 и образуется сода [ур-ия (12)-(15)]. При взаимодействии же едкого натра с минеральными соединениями ма- гния также переходит в осадок Mg(0H)2, а в растворе остается соответствующая минеральная соль натрия NaCl, Na2S04 или, в редких случаях, NaNOa [ур-ия (21) и (22)]. Что же касается минеральных солей кальция, то они требуют для своего осаждения соды: прежде всего с ними реагируют те количества соды, которые вновь образовались, согласно ур-иям (13)-(15); эта сода должна приниматься в расчет при вычислении необходимых прибавок соды для умягчения В. Различие между последним способом и содово-известковым практически заключается в том, что при применении соды и едкого натра в водоочистителе получается меньше осадков. Поэтому в случаях очень жестких вод, с большой магнезиальной жесткостью, этот способ является пригодным, но он дороже содово-известкового. При применении одной соды получают, как уже сказано, хорошие результаты с гипсом или же с хлористым кальцием,- вообще с минеральными соединениями кальция. Химич. реакции соды с солями магния [ур-ия (17) и (19)] не протекают количественно полностью, и в питательной В. может остаться, напр., хлористый или сернокислый магний, чрезвычайно опасные для парового котла. По Мразеку, сернокислый магний разъедает железо. Получающийся в результате этих реакций углекислый магний [см.также ур-ия(28),(29)] тоже остается в большинстве случаев в растворе и поступает в котел, где он, гл. обр. под действием едкого натра, получающегося вследствие гидролиза соды, дает обильные осадки. Что касается реакций соды со свободной углекислотой и бикарбонатами кальция и магния [ур-ия (23)-(25)], то при них образуется бикарбонат натрия, разлагающийся в котле с выделением вредного углекислого газа: 2 NaHCO,= NajCO,--CO,--H,0. Кроме того, реакции (24) и (25) протекают удовлетворительно при высоком подогреве В. и большом избытке соды. Отсюда ясно, что применение одной соды для водоумягче-ния вне котла можно рекомендовать только в редких случаях,-гл. обр. тогда, когда в очищаемой воде сильно преобладает гипс, мала бикарбонатная жесткость и ничтожно содержание магния. В практике этот способ комбинируется с постоянными продувками котла, при чем котловая В. полностью или частью отводится в водоумягчитель (аппараты Неккар и др.); при этом частью утилизируются содержащиеся в котловой В. в избытке реактивы (едкий натр, сода) и тепло. За последние годы, вследствие многих присущих указанному способу недостатков, преимущество стали отдавать содово-известковому способу в комбинации с постоянными продувками котлов. Необходимо упомянуть еще о т а р т р и-цидном способе умягчения воды, заключающемся в прибавлении к ней фосфорно-натриевой соли NajHPOi или NagPOj [ур-ия (46)-(49)]. Названный способ привлек к себе в последние годы, гл. обр. в С.-А. С. Ш., большое внимаргае, и ему с распространением высокомощных котельных установок, невидимому, предстоит значительная роль. Из различных соединений фосфорной к-ты наибольшее применение получил фосфорнокислый натрий ЫазР04 как наиболее дешевый реактив; в последнем отношении он, правда, уступает кальцинированной углекислой соде, будучи у нас значительно дороже последней. Впрочем оба названных реактива могут рапионально дополнять друг друга, когда химической очистке подлежат значительные количества воды; в таких случаях в качестве основных реактивов мол{;но употреблять, как наиболее дешевые, известь и соду или (при малой бикарбонатной жесткости воды) едкий натр, а фос-форнонатриевую соль прибавлять к воде вслед за ними. При этом рекомендуется работать без избытка соды. Преимуш;ества фосфорнокислого натрия перед углекислой содой заключаются прежде всего в том, что сода, как было упомянуто выше, в работающем паровом котле гидролизуется на едкий натр и углекислоту, при чем уже при 15 atm избыточного давления получается около 65 % едкого патра. Т. к. при содово-известковом способе избыток необходим также и в котловой В. (напр. во избежание регенерации гипса за счет извести и ионов серной к-ты), то, чем выше рабочее давление и чем фор-сированнее работает котел, тем больше требуемый избыток. Но при этом быстро нарастает и концентрация едкого натра, как продукта гидролитическ. разложения соды, так что требуются более частые и продолжительные продувки котлов, чтобы избежать вредного или далее угрожающего наконления гидроокиси натрия. Фосфорнокислый натрий значительно устойчивее против высоких темп-р, и его требуется меньше для воспрепятствования образованию в котле гипса, дающего твердую накипь. Для определения ко личества потребных реактивов наиболее надежным является производство опытной лабораторной очистки В. При теоретич. подсчете кладут в основание следующие числовые отношения. Для умягчения 1 В. на 1 нем. градус карбонатной жесткости требуется 10 г 100%-ной окиси кальция. Кроме того, прибавляют по 1,4 г того же реактива на каждый г окиси магния, содержащейся в 1 очищаемой В. Для связывания каждого мг свободной углекислоты, содержащейся в 1 jh той же В., прибавляют 1,27 г 100%-пой окиси кальция. Наконец, для удаления из 1 м В. одного нем. градуса некарбонатной жесткости прибавляют 18,9 г химически чистой кальцинированной соды КазСОз (100%-ной) или 51 г кристаллическ. соды (КагСОз.ЮНгО). Вместо 10 г СаО берут 14,29 г NaOH. Образующиеся при реакциях с бикарбонатной жесткостью количества соды принимают в расчет при вычислении необходимых добавок последней для удаления некарбонатной жесткости. Выше было упомянуто, что сода подается к очищаемой В. с нек-рым избытком. Часть последнего идет на осаждение силикатов (кремнезема) и органич. веществ. По исследованиям Гольдберга, силикаты накипеоб-разователей либо совсем не удаляются либо удаляются в очень ничтожной степени при прибавлении едкого кальция. Кохенгау-зен рекомендует делать прибавки реактивов Пфейфера по следующим ф-лам (в г на л): окись кальция= а + \ЛЬ 0,786 сода=18,9Я-2,41а, где а-число мг связанной углекислоты в 1 л, &-число мг MgO в 1 л и Н-общая жесткость в нем. градусах. Шплитгербер предлагает для расчета немного видоизмененные ф-лы Гундесгагена (в г на м): едкая известь = 10,0{К+Мд+С), сода = 18,9Л, где обозначают в нем. градусах: К-карбонатную жесткость, Мд-.магнезиальную жесткость, N-некарбонатную (постоянную) жесткость и С-т. н. эквивалент жесткости для свободной углекислоты (т. е. содержание свободной СО2 в лег на л, умноженное на коэфф. 0,127). При применении для водо-умягчения едкого натра и соды Шплитгербер предлагает следующие видоизмененные ф-лы Гундесгагена (в г на м): NaOH = Мд±с1 иМК+Мд + С), Na.COg = lSMN-K~Mg - С), или, т. к. N=Ca + Мд - К, Na,C03=Ca- 2А- С (Са здесь обозначает известковую жесткость, остальные обозначения - прелсние). При умягчении воды одной содой прибавляют по 18,9 г на каждый нем. градус удаляемой жесткости, считая на 1 м умягчаемой В. При применении постоянных продувок количество прибавок реактива проще всего определять на основании анализа очищаемой В. из водоочистителя после ее смешения в аппарате с продувочной котловой В. Такие анализы В. должны периодически производиться в заводской лаборатории и служить основой для всех мероприятий по очистке В. При этом для вычисления прибавок могут служить упомянутые формулы, или же прибавки устанавливаются на основании опытной очистки. Для определения количества едкого натра, попадающего в водоочиститель вместе с продувочной котловой В. и образующегося в последней вследствие гидролитич. разложения углекислого натрия, могут служить средние значения, приведенные в табл. 16. Табл. 16.-с одержание NaOH в% к содержанию NaaCO, в котловой воде.
Для упрощения расчетов все содержащиеся в В. соединения, а равно и требующиеся для водоумягчения реактивы м. б. вычислены в одних и тех же единицах, напр. в нем. градусах жесткости, при чем одному нем. градусу жесткости соответствуют, или эквивалентны (в жз на 1 л воды): 7,14 Са; ЮСаО; 13,21 Са(ОН),; 17,86 СаСО,; 28,93 Са(НСО,),: 24,29 CaSO,; 19,82 CaCl,; 4,28 Mg: 7,14 MgO; 10,36 Mg(OH),; 15,00 MgCO,; 26,07 MgCHCO,),; 21,43 MgSOt; 16,96 MgCI,; 14,29 NaOH; 18,93 Na,CO,; 30,00 NaHCO,; 19,65 Na,PO ; 35,18 BaCOj. Что касается кислотных ангидридов COj, SOj, CI и др., то одному нем. градусу соответствует, или эквивалентно, такое количество их, которое связывается с 10 лг СаО. Так, одному немецкому градусу карбоната эквивалентно содержание 7,86 мг СОа или 10,7 лег СО3 на 1 л; 1 нем. градусу сульфата эквивалентно содержание 14,29 мг SO3 или 17,1 мг SO4; 1 немецкому градусу хлорида- 12,68 мг С1. Вместо того чтобы найденные анализом числа мг оснований и кислотных ангидридов делить на вышеприведенные йоэфф-ты с целью выражения их в единицах жесткости (в нем. градусах), еше проще, для достижения той же цели, умножать их на коэфф-ты, приведенные в табл. 17. Табл. 17.-к оэфф-ты для перевода веса оснований и кислотных ангидридов в единицы жесткости. Название основания или ангидрида Коэфф-т Окись кальция СаО..... Кальций Са ......... Окись магния MgO..... Магний Mg......... Сернокислый ангидрид SO, Сульфат SO,......... Углекислый газ СО,..... Карбоиат СО,........ Хлор С1........... Карбонат кальция СаСО,. . Сульфат CaSO . . Хлористый кальций CaCl, . Углемагниевая соль MgCO, Серномагниевая MgSO, Хлористый магний MgCl, . 0,10 0,14 0,14 0,23 0,07 0.059 0,127 0,093 0.079 0,056 0,0И 0,050 0,067 0,047 0,059 Пользуясь этими коэфф-тами, можно с достаточным для практич, целей приближением судить о правильности произведенного полного анализа воды. Дальнейшим упрощением является пересчет данных химического анализа на миллиграмм-эквиваленты, так как последними пользуются и при изготовлении титрованных растворов для объемных анализов В. Приведенные числовые значения для различных химическ. соединений, выраженные в нем. градусах, были получены делением соответствующих миллиграмм-эквивалентов на децимиллиграмм-эквива-лент СаО (28 лег : 10=2,8 jus СаО). Миллиграмм-эквиваленты некоторых наиболее часто встречающихся в водоочищении соединений приведены в табл. 18. Табл. 18. - Миллиграмм-эквиваленты главнейших соединений.
Химические водоочистители. Для русских техников небезынтересны будут некоторые сведения о работе водоочистителей в СССР. На фиг. 21 показан водоочистительный аппарат системы автора. Водоочиститель м. б. снабжен специальным водо-подогревателем. Сырая В. поступает в бак 1, имеющий водосливное устройство, разделяющее при помощи передвижных дисков всю 31пПодводсырой воды - Распределителе воды 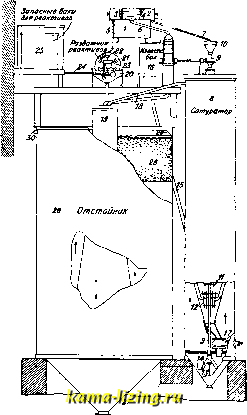 Фиг. 21. В., соответственно ее составу, на отдельные струи, направляемые трубой 7 в сатуратор, трубой 5 на малое гидравлич. колесо раздатчика реактивных растворов 20 и трубой б на большое гидравлич. колесо, а при отсутствии последнего-непосредственно в смеситель 19 (гидравлич. привод м. б. заменен электрическим, для чего достаточно 7* Н*)-Сатуратор 8 служит для приготовления насыщенного профильтрованного известкового раствора. Сатуратор имеет внутри одну или несколько коническ. перегородок, разделяющих его на отдельные камеры. В верхней части его помещен фильтр. Из воронки 10 через полый вал 9 и его ответвления Ы вода вытекает вблизи днища сатуратора, где тщательно перемешивается с известью, подаваемой в верхнюю его камеру в виде известкового молока. Перемешивание производится мешалкой 13, ответвлениями 14, а также действием струй, вытекающих через ответвления. Известковый раствор, заполнив нижнюю камеру сатуратора, попадает
|
||||||||||||||||||||||||||||||||||||||||||||||||||